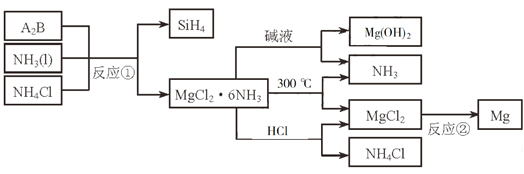
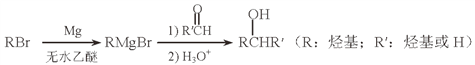
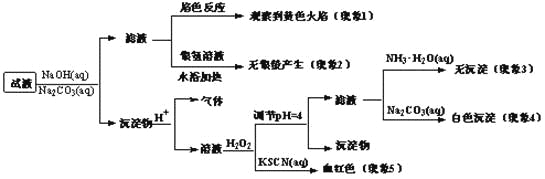
题目内容
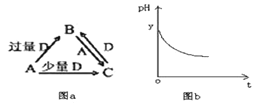
【题目】常温下,pH均为2、体积均为V0的HA、HB、HC溶液,分别加水稀释至体积为V,溶液pH随lg![]() 的变化关系如图所示,下列叙述错误的是
的变化关系如图所示,下列叙述错误的是

A. 常温下:Ka(HB)>Ka(HC)
B. HC的电离度:a点<b点
C. 当lg![]() =4时,三种溶液同时升高温度,
=4时,三种溶液同时升高温度, ![]() 减小
减小
D. 当lg![]() =5时,HA溶液的pH为7
=5时,HA溶液的pH为7
【答案】D
【解析】A项,由图可知,HA稀释10倍pH增大1,则HA为强酸,HB、HC稀释10倍pH增大值小于1,则HB、HC为弱酸,HB、HC稀释同等倍数,pH的改变值:HB![]() HC,酸性:HB
HC,酸性:HB![]() HC,常温下,Ka(HB)
HC,常温下,Ka(HB)![]() Ka(HC),正确;B项,对HC,b点稀释的倍数大于a点,加水稀释促进弱酸的电离,HC的电离度:a点
Ka(HC),正确;B项,对HC,b点稀释的倍数大于a点,加水稀释促进弱酸的电离,HC的电离度:a点![]() b点,正确;C项,HA为强酸,对HA溶液升高温度, c(A-)不变,对HC溶液升高温度促进HC电离,c(C-)增大,
b点,正确;C项,HA为强酸,对HA溶液升高温度, c(A-)不变,对HC溶液升高温度促进HC电离,c(C-)增大, ![]() 减小,正确;D项,HA溶液为酸溶液,无论如何稀释pH
减小,正确;D项,HA溶液为酸溶液,无论如何稀释pH![]() 7,错误;答案选D。
7,错误;答案选D。

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案
相关题目