��Ŀ����
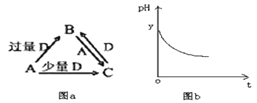
����Ŀ���ڻ�ѧ��Ӧ�У�ֻ�м�����������ƽ�������ߵö�ķ�Ӧ����ӷ�����ײʱ�ſ��ܷ�����ѧ��Ӧ����Щ���ӳ�Ϊ����ӣ�ʹ��ͨ���ӱ�ɻ���������ṩ������ȵ������л�ܣ��䵥λͨ����kJ/mol��ʾ��������۲���ͼ��Ȼ��ش����⣺
��1��ͼ����ʾ��Ӧ��(����ȡ����ȡ�)��Ӧ���÷�Ӧ�ġ�H=(�ú�E1��E2�Ĵ���ʽ��ʾ)��
��2������4����Ӧ�з���ʾ��ͼ�����ķ�Ӧ����____________(�����)��
A.ˮ������̿��Ӧ
B.��ˮϡ������������Һ
C.������Fe2O3��Ӧ
D.���ȵ�̼��CO2��Ӧ
��3����֪�Ȼ�ѧ����ʽ��H2(g)+ ![]() O2 (g)=H2O(g)��H=-241.8kJ/mol���÷�Ӧ�Ļ��Ϊ167.2 kJ/mol�������淴Ӧ�Ļ��Ϊ��
O2 (g)=H2O(g)��H=-241.8kJ/mol���÷�Ӧ�Ļ��Ϊ167.2 kJ/mol�������淴Ӧ�Ļ��Ϊ��
��4���Լ���Ϊԭ����ȡ�����ǹ�ҵ�ϳ��õ����ⷽ������֪��
CH4 (g)+H2O(g)=CO(g)+3H2(g)��H=+206.2 kJ/mo1
CH4(g)+CO2 (g)=2CO(g)+2H2 (g)�� H=+247��4kJ/mo1
CH4 (g)��H2O(g)��Ӧ����CO2(g)��H2(g)���Ȼ�ѧ����ʽΪ��
���𰸡�
��1�����ȣ�(E2-E1)kJ/mol
��2��C
��3��409.0KJ/mol
��4��CH4(g)+2H2O(g)�TCO2(g)+4H2(g)��H=165.0kJ/mo1
����������1������ͼ�������Ӧ��������������������������Ӧ���ȣ���Ӧ���ʱ�=�����������-��Ӧ�������������H=(E2-E1)kJ/mo1��
��2��A��ˮ������̿��Ӧ�������ȷ�Ӧ��A���������⣻
B����ˮϡ������������Һ�����ڻ�ѧ��Ӧ��B���������⣻
C��������Fe2O3��Ӧ�ķ�Ӧ���ڷ��ȷ�Ӧ��C�������⣻
D�����ȵ�̼��CO2��Ӧ�������ȷ�Ӧ��D���������⣻
��3����Ӧ�Ļ����ʹ��ͨ���ӱ�ɻ���������ṩ������ȵ�����������ͼ��������ϵ��֪���淴Ӧ�Ļ��=����Ӧ�Ļ��+��Ӧ���ʱ䣻H2(g)+ ![]() O2(g)�TH2O(g)��H=-241.8kJ/mo1���÷�Ӧ�Ļ��Ϊ167.2kJ/mol�������淴Ӧ�Ļ��=167.2KJ/mol+241.8KJ/mol=409.0KJ/mol��
O2(g)�TH2O(g)��H=-241.8kJ/mo1���÷�Ӧ�Ļ��Ϊ167.2kJ/mol�������淴Ӧ�Ļ��=167.2KJ/mol+241.8KJ/mol=409.0KJ/mol��
��4����CH4(g)+H2O(g)�TCO(g)+3H2(g)��H=206.2kJ/mol��
��CH4(g)+CO2(g)�T2CO(g)+2H2(g)��H=247.4kJ/mol���ݸ�˹���ɣ��١�2-�ڵã�CH4(g)+2H2O(g)�TCO2(g)+4H2(g)��H=165.0kJ/mol��
���Դ��ǣ���1�����ȣ�(E2-E1)kJ/mol����2��C����3��409.0KJ/mol����4��CH4(g)+2H2O(g)�TCO2(g)+4H2(g)��H=165.0kJ/mol
�����㾫�����������⣬������Ҫ�˽ⷴӦ�Ⱥ��ʱ�(�ڻ�ѧ��Ӧ�зų������յ�������ͨ���з�Ӧ��)��

 Ӯ�ڿ�����ʦ��ʱ�ƻ�ϵ�д�
Ӯ�ڿ�����ʦ��ʱ�ƻ�ϵ�д� �������Ͽ�ʱͬ��ѵ��ϵ�д�
�������Ͽ�ʱͬ��ѵ��ϵ�д�