题目内容
【题目】(1)在Na2SO4和Al2(SO4)3的混合溶液中,测得Al3+浓度为0.1 mol·L-1,加入等体积0.3 mol·L-1的BaCl2溶液恰好使![]() 完全沉淀,则混合溶液中Na+的浓度为________。
完全沉淀,则混合溶液中Na+的浓度为________。
(2)将0.1 mol·L-1的K2SO4溶液、0.2 mol·L-1的Al2(SO4)3溶液和纯水混合,要使混合液中K+、Al3+、![]() 的浓度分别为0.1 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,则K2SO4溶液、Al2(SO4)3溶液、纯水三者的体积比________(忽略体积的变化)。
的浓度分别为0.1 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,则K2SO4溶液、Al2(SO4)3溶液、纯水三者的体积比________(忽略体积的变化)。
(3)在标准状况下,将一个充满HCl气体和氧气的集气瓶倒放于盛水的水槽中,水面上升至集气瓶容积的![]() ,把集气瓶从水中取出(假设HCl全部留在集气瓶中),若溶液密度的变化忽略不计,则HCl的物质的量浓度为________ mol·L-1。
,把集气瓶从水中取出(假设HCl全部留在集气瓶中),若溶液密度的变化忽略不计,则HCl的物质的量浓度为________ mol·L-1。
【答案】0.3 mol·L-1 2∶1∶1 0.045
【解析】
(1)先计算c(SO42-),再结合电荷守恒分析;
(2)设K2SO4溶液、Al2(SO4)3溶液、纯水三者的体积分别是xL、yL、zL,则0.2x=0.1×(x+y+z)、0.4y=0.1×(x+y+z)、0.1x+0.6y=0.2×(x+y+z),据此分析;
(3)HCl极易溶于水,氧气不易溶于水,所以水面上升的体积就是HCl的体积,据此分析;
(1)根据反应Ba2++SO42-=BaSO4↓,混合溶液中加入等体积0.3 mol·L-1的BaCl2溶液恰好使SO42-完全沉淀,则c(SO42-)=0.3mol/L;由电荷守恒可得:3c(Al3+)+c(Na+)=2c(![]() ),所以c(Na+)=2c(
),所以c(Na+)=2c(![]() )-3c(Al3+)=2×0.3mol/L-3×0.1mol/L=0.3mol/L。
)-3c(Al3+)=2×0.3mol/L-3×0.1mol/L=0.3mol/L。
故答案为:0.3mol·L-1;
(2)设K2SO4溶液、Al2(SO4)3溶液、纯水三者的体积分别是xL、yL、zL,则0.2x=0.1×(x+y+z)、0.4y=0.1×(x+y+z)、0.1x+0.6y=0.2×(x+y+z),解得x=2y=2z,所以K2SO4溶液、Al2(SO4)3溶液、纯水三者的体积比为2∶1∶1。
故答案为:2∶1∶1;
(3)HCl极易溶于水,氧气不易溶于水,所以水面上升的体积就是HCl的体积,设容器体积为VL,水面上升至集气瓶容积的![]() 就停止了,则氯化氢体积=
就停止了,则氯化氢体积=![]() VL,溶液体积为
VL,溶液体积为![]() VL,n(HCl)=
VL,n(HCl)= =
=![]() mol,盐酸浓度c=
mol,盐酸浓度c=![]() =
=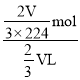 =
=![]() mol·L-1=0.045mol·L-1。
mol·L-1=0.045mol·L-1。
故答案为:0.045。