题目内容
【题目】配平下列反应的化学方程式,标出电子转移方向和数目,并回答有关问题:
Na2Cr2O7+KI+HCl →CrCl3 +NaCl +KCl+I2 + __________ __________。
(1)上面反应中氧化剂是____,被氧化的元素是___。
(2)HCl的作用___。
(3)若反应过程中有0.50molI2被氧化出来,且有__mol电子发生了转移。
【答案】Na2Cr2O7+6KI+14HCl →2CrCl3 +2NaCl +6KCl+3I2 +7H2O 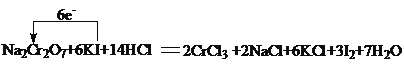 Na2Cr2O7 -1价I 酸 1
Na2Cr2O7 -1价I 酸 1
【解析】
Cr元素化合价由+6价降低为+3价,I元素的化合价由-1价升高为0,根据氧化还原反应的规律和原子守恒分析。
反应中,Cr元素化合价由+6价降低为+3价,得到的电子数为:2![]() (6-3)=6, I元素的化合价由-1价升高为0,失去的电子数为:2
(6-3)=6, I元素的化合价由-1价升高为0,失去的电子数为:2![]() [0-(-1)]=2,根据电子转移数相等可知,Na2Cr2O7的化学计量数为1,I2,的化学计量数为3,由原子守恒最后配平可得, Na2Cr2O7+6KI+14HCl=2CrCl3+2NaCl+6KCl+3I2+7H2O,用单线桥表示其电子转移的方向和数目为:
[0-(-1)]=2,根据电子转移数相等可知,Na2Cr2O7的化学计量数为1,I2,的化学计量数为3,由原子守恒最后配平可得, Na2Cr2O7+6KI+14HCl=2CrCl3+2NaCl+6KCl+3I2+7H2O,用单线桥表示其电子转移的方向和数目为: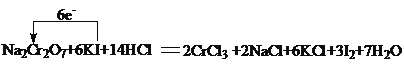 ;
;
(1)氧化剂为元素得电子所对应的反应物,则上面反应中氧化剂是Na2Cr2O7,而被氧化的元素则是失电子的元素,为-1价的I元素,故答案为:1Na2Cr2O7+6KI+14HCl →2CrCl3 +2NaCl +6KCl+3I2 +7H2O ;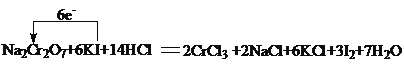 ;Na2Cr2O7;-1价I;
;Na2Cr2O7;-1价I;
(2)HCl最终生成CrCl3、NaCl和KCl三种盐,因此HCl起酸性作用,故答案为:酸性;
(3)根据第(1)问可知,反应中6e-![]() 3I2,若反应过程中有0.50mol I2被氧化出来,则转移的电子数为0.50mol
3I2,若反应过程中有0.50mol I2被氧化出来,则转移的电子数为0.50mol![]() 2=1 mol,故答案为:1。
2=1 mol,故答案为:1。

【题目】将X逐渐加入(或通入)到一定量Y溶液中,产生沉淀的质量与加入X的物质的量关系如图,
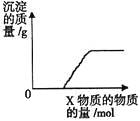
符合图中情况的一组物质是
A | B | C | D | |
X | Ba(HCO3)2 | Na2CO3 | KOH | CO2 |
Y | NaOH | CaCl2 | Mg(HSO4)2 | 石灰水 |
A.AB.BC.CD.D