题目内容
10.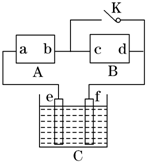 如图所示,A为直流电源,B为渗透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
如图所示,A为直流电源,B为渗透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:(1)电源A的a为正极.
(2)滤纸B上发生的总反应方程式为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑.
(3)欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路,其中电极e为锌(填“Fe”或“Zn”)则电极e上发生的反应为:Zn-2e-═Zn2+.
分析 (1)由B上的c点显红色判断c的电极,根据c的电极判断a、b的电极;
(2)根据溶液中离子的放电顺序判断生成物,由反应物、生成物写出相应的方程式;
(3)先判断e、f的电极,再根据阴阳极上发生的反应写出相应的电极反应式.
解答 解:(1)B外接电源,所以是电解氯化钠溶液的电解池,接通电路后,发现B上的c点显红色,B上的c点显红色,说明c点有氢氧根离子生成,根据离子的放电顺序知,该极上氢离子得电子放电,所以c是阴极,外电源b是负极,a是正极,
故答案为:正;
(2)电解氯化钠溶液时,溶液中的离子放电顺序为:氢离子放电能力大于钠离子,氯离子放电能力大于氢氧根离子,所以电解氯化钠时生成物是氯气、氢气、氢氧化钠,所以其反应方程式为 2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑,
故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑;
(3)电镀时,e是阳极,f是阴极,镀层锌作阳极,镀件铁作阴极,阳极上失电子变成离子进入溶液,阴极上锌离子得电子生成锌单质,所以阳极上电极反应式为Zn-2e-=Zn2+;故答案为:锌;Zn-2e-═Zn2+.
点评 本题考查了电解原理与电镀池,判断电极是关键,离子掌握溶液中离子的放电顺序及电极反应方程式书写,难度中等.

练习册系列答案
相关题目
7.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 将1mol铁粉加入到一定量的稀硝酸溶液中充分反应,转移的电子数一定是3NA | |
| B. | 标准状况下,22.4L己烷中共价键数目为19NA | |
| C. | 由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA | |
| D. | 1.0 L 1.0 mol•L-1 NaClO溶液中含有ClO-离子的数目为NA |
8.品红分子结构中的发色基团遇到SO2与水形成的亚硫酸后结构发生改变,生成不稳定的无色化合物.亚硫酸漂白原理可用下面的反应方程式表示下列说法不正确的是( )
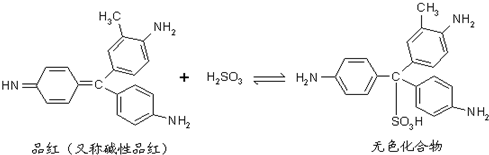

| A. | 品红的分子式为C20H19N3 | |
| B. | 上述漂白原理反应属加成反应 | |
| C. | 碱性品红及其与H2SO3生成的无色化合物都可与NaOH溶液反应 | |
| D. | 碱性品红与H2SO3生成的无色化合物不稳定,加热后恢复原来的颜色 |
5.标准状况下,将5.6L由CO、CH4、C2H4、C2H2组成的混合气体与18LO2混合于某密闭容器中点燃,反应完成后再恢复到原状况,得CO2气体7.50L,则下列判断正确的是( )
| A. | 反应完成后,O2有剩余 | |
| B. | 原混合气体中,C2H4与C2H2的体积共为1.9L | |
| C. | 反应完成后,生成水的质量为9g | |
| D. | 原混合气体中,CO与CH4的体积比一定为1:1 |
2.设nA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 0.1 mol•L-1NaCl溶液中含有0.1nA个Na+ | |
| B. | 标准状况下,22.4 L 苯含有nA个苯分子 | |
| C. | 7.8 g Na2O2与足量水反应转移0.2nA个电子 | |
| D. | 标准状况下,2.24 LCH4和C2H4混合气体中含有的H原子数为0.4nA |
19.影响化学反应速率的主要因素是( )
| A. | 温度 | B. | 催化剂 | C. | 物质的性质 | D. | 浓度 |
20.(1)已知X、Y、Z为同一短周期的三种元素,其原子的部分电离能(kJ/mol)如表所示:
①三种元素电负性大小关系为Z>Y>X
②写出Y原子的电子排布式1s22s22p63s2 Y的第一电离能大于Z的第一电离能的原因Y元素原子最外层s轨道上的电子为全满
③X晶体采用图1中A(填字母) 堆积方式.
(2)N2O的等电子体为:①分子CO2,②阴离子SCN- 或N3-;由此可知N2O的中心原子的杂化类型为SP.根据价层电子对互斥模型确定NO2的分子构型为:V型.
(3)已知铜能形成多种化合物,如硫酸铜的结构如图2所示,请在图中标出水合铜离子中的配位键.

| X | Y | Z | |
| I1 | 496 | 738 | 577 |
| I2 | 4562 | 1451 | 1817 |
| I3 | 6912 | 7733 | 2754 |
| 9540 | 10540 | 11578 |
②写出Y原子的电子排布式1s22s22p63s2 Y的第一电离能大于Z的第一电离能的原因Y元素原子最外层s轨道上的电子为全满
③X晶体采用图1中A(填字母) 堆积方式.
(2)N2O的等电子体为:①分子CO2,②阴离子SCN- 或N3-;由此可知N2O的中心原子的杂化类型为SP.根据价层电子对互斥模型确定NO2的分子构型为:V型.
(3)已知铜能形成多种化合物,如硫酸铜的结构如图2所示,请在图中标出水合铜离子中的配位键.

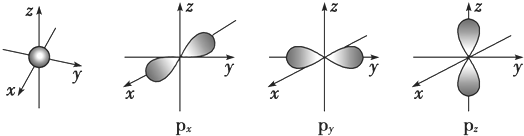
 .若元素X的原子最外层电子排布式为nsn-1npn+1,那么X的元素符号为S,原子的电子排布图为
.若元素X的原子最外层电子排布式为nsn-1npn+1,那么X的元素符号为S,原子的电子排布图为 .
.