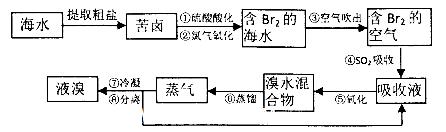
题目内容
用于分离或提纯物质的方法有:A蒸馏(分馏);B萃取;C过滤;D重结晶;E分液。下列各组混合物的分离或提纯应选用上述哪一种方法最合适?(填方法的标号)
(1)淀粉液中含有泥沙 ;
(2)分离四氯化碳与水的混合物 ;
(3)分离汽油和煤油 ;
(4)分离碘水中的碘单质 ;
(5)KNO3晶体中含有少量食盐 。
(1)C (2)E (3)A (4)BE (5)D
解析试题分析:(1)淀粉液中含有泥沙,泥沙不溶解于水,淀粉溶解,故采用过滤法分离。(2)分离四氯化碳与水的混合物它们是互不相溶的液体,可采用分液法分离。(3)分离汽油和煤油 二者互溶且沸点不同,可采用蒸馏方法分离。(4)分离碘水中的碘单质 可以利用碘单质在四氯化碳中的溶解度比在水中的大,水和四氯化碳互不相溶的性质采用萃取然后分液的方法分离。(5)KNO3晶体中含有少量食盐利用食盐的溶解度受温度的影响变化不大,而KNO3的溶解度受温度的影响变化较大,先把固体溶解在水中,配成高温下的饱和液,然后降低温度,硝酸钾大部分结晶析出,杂质氯化钠仍然溶解在水中,用结晶、重结晶的方法分离提存。所以正确选项为:(1)C (2)E (3)A (4)BE (5)D
考点:考查分离或提纯物质的方法的知识。

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成,由蛇纹石制取碱式碳酸镁的实验步骤如下: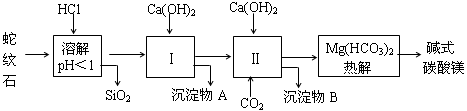
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是 。
(2)进行Ⅰ操作时,控制溶液的pH=7~8(有关氢氧化物沉淀的pH见下表),Ca(OH)2不能过量,若Ca(OH)2过量可能会导致 溶解,产生 沉淀。
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
(3)从沉淀混合物A中提取红色氧化物作为颜料,先向沉淀物A中加入 (填加入物质的化学式),然后 (依此填写实验操作名称)。物质循环使用,能节约资源。上述实验中,可以循环使用的物质是 (填写物质的化学式)。
(4)现设计实验,确定产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值。请写出下列实验步骤中所需要测定的项目(可用试剂:浓硫酸、碱石灰、氢氧化钠溶液、澄清石灰水):①样品称量,②高温分解,③ ,④ ,⑤MgO称量。
(5)从下列仪器(装有必要的试剂)中选择完成上述实验所必需的仪器,连接一套装置 (选择仪器代号,可重复使用,用“A→B→……→”表示)

(6)18.2g产品完全分解后,产生6.6gCO2和8.0gMgO,由此可知,产品的化学式中a= ,b= ,c= 。
为了达到下列表格中的实验要求,请从供选择的化学试剂及实验方法中选出合适的,将其标号填入对应的空格中。
| 实验要求 | 试剂及方法 |
| 证明明矾水溶液呈酸性 | |
| 鉴别甲烷与乙烯 | |
| 除去MgO中含有的Al2O3 | |
| 鉴别乙醇和乙醛 | |
供选择的化学试剂及实验方法
A.新制的Cu(OH)2
B.加盐酸,过滤
C.将溶液滴在pH试纸上
D.加入过量浓NaOH溶液,过滤
E.酸性KMnO4溶液

 Cu AlO2 + (系数1也要写).
Cu AlO2 + (系数1也要写).

 、
、
 。要软化10 m3这种天然水,需先加入Ca(OH)2 g,再加入Na2CO3 g。
。要软化10 m3这种天然水,需先加入Ca(OH)2 g,再加入Na2CO3 g。