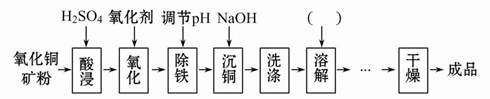
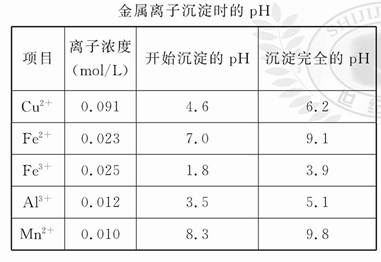
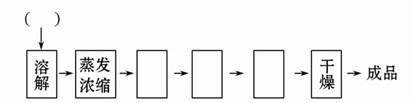
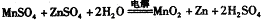题目内容
银铜合金广泛应用于航空工业。从切割废料中回收银并制备铜的化工产品CuAlO2的工艺如下:(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)
(1)铜的核外电子排布式为 .
(2)电解精炼银时,阴极反应式为 滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学方程式为 .
(3)固体混合物B的组成为 ;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,最后将得不到CuAlO2 ,写出因NaOH过量引起的反应的离子方程式 .
(4)若将上述流程图中加入的稀NaOH溶液改为加入过量的氨水(其它均不变),则滤液中的阳离子有 .
(5)完成上述煅烧过程中一个反应的化学方程式:
CuO + Al2O3 Cu AlO2 + (系数1也要写).
Cu AlO2 + (系数1也要写).
(6)若银铜合金中铜的质量分数为64%,理论上5.0kg废料中的铜可完全转化为CuAlO2,至少需要1.0mol·L-1的Al2(SO4)3溶液 L .
(1)1s2s22p63s23p63d104s1或[Ar]3d104s1 (2)Ag++e-=Ag 2NO+O2=2NO2
(3)Al(OH)3和CuO Al(OH)3+OH-=AlO2—+2H2O(4)[Cu(NH3)4]2+、NH4+、、H+、Na+。(5)4 2 =4 1 O2↑ (6)25.0
解析试题分析:(1)Cu是29号元素,其核外电子排布式为1s2s22p63s23p63d104s1或[Ar]3d104s1(2)电解精炼金属时,粗金属作阳极,精金属作阴极。阳极反应氧化反应,阴极发生还原反应。所以电解精炼银时,阴极精银上的反应式为Ag++e-=Ag。滤渣A与稀HNO3反应,产生的无色气体是NO,它遇空气迅速变为红棕色的NO2,该气体变色的化学方程式为2NO+O2=2NO2。(3)发生的反应为:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4; Al2(SO4)3+6NaOH=2Al(OH)3↓+3Na2SO4; 100度煮沸时氢氧化铜发生分解反应:Cu(OH)2 CuO+H2O. Al(OH)3不分解。所以得到的固体混合物B是Al(OH)3和CuO。氢氧化铝能被过量的强碱溶解产生容易溶解于水的偏铝酸盐。NaOH过量引起的反应的离子方程式Al(OH)3+OH-=AlO2—+2H2O。 (4)氢氧化铝只能被强碱溶解而不能溶解在氨水中。若将上述流程图中加入的稀NaOH溶液改为加入过量的氨水(其它均不变),Cu2+与NH3结合形成[Cu(NH3)4]2+,就不再产生氢氧化铜沉淀,铝以氢氧化铝的形式存在固体沉淀中。则滤液中含有的阳离子有[Cu(NH3)4]2+、NH4+、、H+、Na+。(5)根据质量守恒定律及电子守恒可知个物质的系数及缺少的物质的化学式是:4 2 == 4 1 O2↑。(6)m(Cu)= 64%×5.0kg=3.2Kg=3200g.n(Cu)=m÷M=3200g÷64g/mol=50mol.。由于在CuAlO2中Cu、Al个数比为1:1.所以根据原子守恒可得:n[Al2(SO4)3]="1/2n(Al)=" 1/2 n(Cu)="25mol." n=C·V.故V=n/C=25mol÷1mol/L=25L.
CuO+H2O. Al(OH)3不分解。所以得到的固体混合物B是Al(OH)3和CuO。氢氧化铝能被过量的强碱溶解产生容易溶解于水的偏铝酸盐。NaOH过量引起的反应的离子方程式Al(OH)3+OH-=AlO2—+2H2O。 (4)氢氧化铝只能被强碱溶解而不能溶解在氨水中。若将上述流程图中加入的稀NaOH溶液改为加入过量的氨水(其它均不变),Cu2+与NH3结合形成[Cu(NH3)4]2+,就不再产生氢氧化铜沉淀,铝以氢氧化铝的形式存在固体沉淀中。则滤液中含有的阳离子有[Cu(NH3)4]2+、NH4+、、H+、Na+。(5)根据质量守恒定律及电子守恒可知个物质的系数及缺少的物质的化学式是:4 2 == 4 1 O2↑。(6)m(Cu)= 64%×5.0kg=3.2Kg=3200g.n(Cu)=m÷M=3200g÷64g/mol=50mol.。由于在CuAlO2中Cu、Al个数比为1:1.所以根据原子守恒可得:n[Al2(SO4)3]="1/2n(Al)=" 1/2 n(Cu)="25mol." n=C·V.故V=n/C=25mol÷1mol/L=25L.
考点:考查原子的核外电子排布、金属的精炼及Cu、Al的化合物的性质的知识。

醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1-溴丁烷的反应如下: ① NaBr+H2SO4 = HBr+NaHSO4;②R-OH+HBr R-Br+H2O
R-Br+H2O
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。有关数据列表如下
| | 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 |
| 密度/g·cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
(1)溴代烃的水溶性 (填“大于”、“等于”或“小于”)相应的醇;其原因是 。
(2)将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在 (填“上层”、“下层”或“不分层”)。
(3)制备操作中,加入的浓硫酸必须进行稀释,目的是 。(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(4)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是 。(填字母)
a.NaI b.NaOH c.NaHSO3 d.KCl
(5)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于 ;但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是 。
现有苯甲酸、苯酚溶于乙醇所得的混合液,某同学设计方案分离三种物质,并检验其中的某些离子和物质。
已知:(1)酸性强弱:HCl>苯甲酸>H2CO3>苯酚> HCO3- (2)部分物理参数如下:
| | 密度 (g·mL-1) | 熔点 (℃) | 沸点 (℃) | 溶解性 |
| 苯甲酸 | 1.2659 | 122.13℃ | 249℃ | 微溶于水,易溶于乙醇、乙醚等有机溶剂 |
| 苯酚 | 1.07 | 40.6 | 181.9 | 易溶于乙醇、乙醚,65℃以上能与水互溶 |
| 乙醇 | 0.79 | -114.3 °C | 78.5 | 与水混溶,可混溶于醚、氯仿、甘油等多数有机溶剂 |
供选择试剂:10%氢氧化钠溶液、0.1mol/L盐酸、0.1mol/LNa2CO3、0.1mol/L NaHCO3、浓溴水、生石灰、0.1mol/L FeCl3、0.1mol/L BaCl2、CO2、0.1mol/L溴水、澄清石灰水
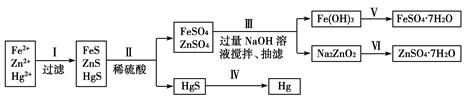
(1)分离物质流程如下:

①物质C是_____________,操作IV是_____________。
②操作III发生的主要化学反应方程式_________________ _______________________________。
③混合液2中加入生石灰的原因是_______。
(2)该同学检验混合液1中是否含有苯酚和NaHCO3,以证明酸性的强弱。
| 实验步骤 | 现象和结论 |
| ①取少量混合液1于试管,滴加________________________, 振荡,静置 | |
| ②取少量步骤①上层清夜于试管,滴加__________________ ____________________________________________________ | 澄清石灰水变浑浊 说明混合液1含有HCO3- |
| ③另取少量混合液1于试管,滴加___________________,振荡 | _________________________, 说明混合液1不含有酚羟基 |
(3)称取2.0g苯甲酸和苯酚的混合固体溶于足量乙醇中,滴加足量饱和NaHCO3溶液,测得放出的CO2(标准状况下,不考虑CO2溶于水)为33.6mL ,则苯甲酸的质量分数为_________________________(只列式,不计算),结果为________。(结果保留1位小数)(苯甲酸的相对分子质量为122,苯酚相对分子质量为94)