题目内容
【题目】一个电化学过程的示意图如图所示。

请回答下列问题:
(l)通入CH3CH2OH一极的电极反应式为__________________________。
(2)乙池是铜的精炼池,则A电极的材料是_____________;反应一段时间后,乙池溶液中c(Cu2+)__________(填“增大”“变小”或“不变”)。
(3)丙池含有0.01 mol KCl的溶液100mL,假如电路中转移了0.03 mol e-,则阳极产生的气体在标准状况下的体积是________。
(4)丙池中滴有酚酞,实验开始后观察到的现象是_______________________________,写出丙池的总反应方程式:________________________________________。
【答案】CH3CH2OH-12e-+16OH-=2CO32-+11H2O 纯铜 减小 224mL 两电极均有气泡冒出,左电极附近溶液变红 2KCl+2H2O ![]() 2KOH+H2↑+Cl2↑
2KOH+H2↑+Cl2↑
【解析】
(l) 乙醇中C元素的化合价升高,则通入CH3CH2OH的电极为负极,失去电子发生氧化反应;
(2) 乙中A与负极相连,则A为阴极,粗铜精炼粗铜为阳极,纯铜作阴极,电解质为可溶性铜盐;
(3)丙池中用惰性电极电解含有0.01 mol KCl的溶液100mL,阳极上先后发生2Cl--2e-=Cl2↑、4OH--4e-=2H2O+O2↑,当电路中转移了0.03 mol e-时结合电子守恒计算阳极产生的氯气和氧气的总体积;
(4) 电解氯化钾溶液,生成氢气、氯气和氢氧化钾,溶液呈碱性。
(l) 乙醇中C元素的化合价升高,则通入CH3CH2OH的电极为负极,失去电子发生氧化反应,电极反应为CH3CH2OH-12e-+16OH-=2CO32-+11H2O;
(2) 乙中A与负极相连,则A为阴极,粗铜精炼粗铜为阳极,则A为纯铜,电解质为可溶性铜盐,可选硫酸铜溶液,因阳极溶解的是Cu和比Cu活泼的金属,而阴极析出的金属为Cu,由电子守恒可知,溶解的Cu和析出的Cu质量不等,则反应一段时间后,乙池溶液中c(Cu2+)减小;
(3) 丙池中用惰性电极电解含有0.01 mol KCl的溶液100mL,阳极上先后发生2Cl--2e-=Cl2↑、4OH--4e-=2H2O+O2↑,则当电路中转移了0.03 mol e-时,溶液中的Cl-完全氧化为氯气,得到0.005mol Cl2,由电子守恒可知,同时生成O2的物质的量为![]() =0.005mol,混合气体的总物质的量为0.005mol+0.005mol=0.01mol,在标准状况下的体积为0.01mol×22.4L/mol=0.224L=224mL;
=0.005mol,混合气体的总物质的量为0.005mol+0.005mol=0.01mol,在标准状况下的体积为0.01mol×22.4L/mol=0.224L=224mL;
(4) 电解氯化钾溶液,生成氢气、氯气和氢氧化钾,溶液呈碱性,可观察到两电极均有气泡冒出,左电极为阴极,氢离子放电后,阴极附近溶液呈碱性,溶液变红,电解总反应式为2KCl+2H2O ![]() 2KOH+H2↑+Cl2↑。
2KOH+H2↑+Cl2↑。

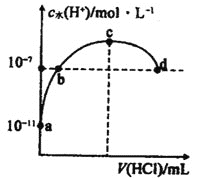
【题目】用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g含有少量中性易溶杂质的样品,配成500 mL待测溶液。称量时,样品可放在________(填字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定过程中,眼睛应注视________________。滴定时,用0.2000molL-的盐酸来滴定待测液,不可选用______(填编号字母)作指示剂。
A.甲基橙 B.石蕊 C.酚酞
(3)滴定时,用0.200 0 mol·L-1的盐酸来滴定待测溶液,根据下表数据,计算被测烧碱溶液的物质的量浓度是________ mol·L-1,烧碱样品的纯度是________。
滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
第一次 | 10.00 | 0.40 | 20.50 |
第二次 | 10.00 | 4.10 | 24.00 |
(4)下列实验操作会对滴定结果产生什么后果?(填“偏高”、“偏低”或“无影响”)
①若将锥形瓶用待测液润洗,然后加入10.00mL待测液,则滴定结果______
②若锥形瓶未干燥就加入10.00mL待测液,则滴定结果______。