题目内容
利用I2O5可消除CO污染或定量测定CO,反应为:5CO(g)+I2O5(s) 5CO2(g)+I2(s);ΔH 1
5CO2(g)+I2(s);ΔH 1
(1)已知:2CO(g)+O2(g) 2CO2(g);ΔH 2
2CO2(g);ΔH 2
2I2(s)+5O2(g) 2I2O5(s);ΔH 3
2I2O5(s);ΔH 3
则ΔH 1= (用含ΔH 2和ΔH 3的代数式表示)。
(2)不同温度下,向装有足量I2O5固体的2 L恒容密闭容器中通入2molCO,测得CO2的体积分数φ(CO2)随时间t变化曲线如图。请回答:
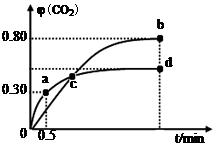
①从反应开始至a点时的反应速率为v(CO)= ,b点时化学平衡常数Kb= 。
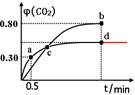
②d点时,温度不变,若将容器体积压缩至原来的一半,请在图中补充画出CO2体积分数的变化曲线。
③下列说法正确的是 。(填字母序号)
(3)将500mL(标准状况)含有CO的某气体样品通过盛有足量I2O5的干燥管,170℃下充分反应,用水—乙醇液充分溶解产物I2,定容到100mL。取25.00mL,用0.0100mol·L-1 Na2S2O3标准溶液滴定,消耗标准溶液20.00mL,则样品气中CO的体积分数为 。(已知:气体样品中其他成分与I2O5不反应;2Na2S2O3+I2=2NaI+Na2S4O6)
 5CO2(g)+I2(s);ΔH 1
5CO2(g)+I2(s);ΔH 1(1)已知:2CO(g)+O2(g)
 2CO2(g);ΔH 2
2CO2(g);ΔH 22I2(s)+5O2(g)
 2I2O5(s);ΔH 3
2I2O5(s);ΔH 3则ΔH 1= (用含ΔH 2和ΔH 3的代数式表示)。
(2)不同温度下,向装有足量I2O5固体的2 L恒容密闭容器中通入2molCO,测得CO2的体积分数φ(CO2)随时间t变化曲线如图。请回答:

①从反应开始至a点时的反应速率为v(CO)= ,b点时化学平衡常数Kb= 。
②d点时,温度不变,若将容器体积压缩至原来的一半,请在图中补充画出CO2体积分数的变化曲线。
③下列说法正确的是 。(填字母序号)
| A.容器内气体密度不变,表明反应达到平衡状态 |
| B.两种温度下,c点时体系中混合气体的平均相对分子质量相等 |
| C.增加I2O5的投料量有利于提高CO的转化率 |
| D.b点和d点的化学平衡常数:Kb<Kd |
(1)2.5ΔH2-0.5ΔH3(3分)
(2)①0.6mol·L-1·min-1(2分,不带单位扣1分),1024 或者45(3分)
②
③AB(2分,选对一个得1分,有错选得0分)
(3)8.96%(3分,三位有效数字,错误扣1分)
(2)①0.6mol·L-1·min-1(2分,不带单位扣1分),1024 或者45(3分)
②

③AB(2分,选对一个得1分,有错选得0分)
(3)8.96%(3分,三位有效数字,错误扣1分)
试题分析:(1)根据盖斯定律,对照第1个反应和第2个反应中CO,对照第1个反应和第3个反应中I2或I2O5,可得ΔH 1=2.5ΔH2-0.5ΔH3。
(2)①设转化的CO物质的量浓度为x,根据三段式进行计算:
5CO(g)+I2O5(s)
 5CO2(g)+I2(s)
5CO2(g)+I2(s) 起始浓度(mol?L?1) 1 0
转化浓度(mol?L?1) x x
平衡浓度(mol?L?1) 1-x x
a点CO2的体积分数为0.3,则x/1=0.3,可得x=0.3mol?L?1,则v(CO)=0.3mol/L÷0.5min = 0.6mol·L-1·min-1;类似a点计算,可求出b点CO的平衡浓度为0.2mol?L?1,CO2的 平衡浓度为0.8mol?L?1,则b点时化学平衡常数Kb=c5(CO2)÷c5(CO)=0.85÷0.25=45。
②d点时,温度不变,若将容器体积压缩至原来的一半,压强增大,因为该反应前后气体的系数相等,所以增大压强,平衡不移动,CO2的体积分数不变,可画出CO2体积分数的变化曲线。
③A、容器内气体密度不变,说明气体的质量不变,则反应达到平衡状态,正确;B、c点时两温度下CO2的体积分数相等,说明气体组成相同,则体系中混合气体的平均相对分子质量相等,正确;C、因为I2O5为固体,增加I2O5的投料量,CO的转化率不变,错误;D、b点CO2的体积分数大,说明b点平衡常数大,所以Kb > Kd,错误。
(3)根据化学方程式可得对应关系:5CO ~ I2~2Na2S2O3,n(CO)=5/2n(Na2S2O3)=5/2×0.0100mol·L-1×0.02L×4=0.002mol,则样品气中CO的体积分数为:0.002mol×22.4L/mol÷0.5L×100%=8.96%

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
 CH3OH(g)。
CH3OH(g)。

 )与季戊四醇(
)与季戊四醇( )以物质的量之比2:1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢蛮如下图所示:
)以物质的量之比2:1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢蛮如下图所示: