题目内容
【题目】已知A、B、C、D、E、F、G七种元素,它们的原子序数依次增大。A在所有元素中原子半径最小;B原子核外电子有6种不同运动状态;D与C、E均相邻;A、D、E三种元素的原子序数之和为25;E2-和F+有相同的核外电子排布;G的质子数是25。请回答下列问题:
(1)写出元素G的基态原子外围电子排布式________;B、C、D三种元素分别形成的最简单氢化物的沸点最高的是________(用化学式表示)。
(2)由上述元素中的两种元素组成的一种阴离子与D的一种同素异形体分子互为等电子体,该阴离子化学式为________。
(3)由上述元素组成的属于非极性分子且VSEPR为直线形的微粒的电子式________(任写一种)。
(4)M是由4个C原子组成的一种不稳定的多原子单质分子,M分子中C原子杂化方式为sp3杂化,M分子的立体构型为________。
(5)某一次性电池的比能量和可储存时间均比普通干电池优良,适用于大电流和连续放电,是民用电池的升级换代产品之一,它的负极材料是Zn,正极材料是G的一种常见氧化物,电解质是KOH。该电池的正极反应式为______________。
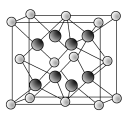
(6)由上述元素中电负性最大的元素和第一电离能最小的元素形成的某化合物N的晶胞如右图所示。化合物N与氧化钙相比,晶格能较小的是______(填化学式)。已知该化合物的晶胞边长为a pm,则该化合物的密度为________g·cm-3(只要求列出算式,不必计算出数值,阿伏加德罗常数的数值为NA,1 pm=10-10cm)。
【答案】(1)3d54s2 H2O
(2)NO![]() (3)
(3) ![]() (或H∶CC∶H)
(或H∶CC∶H)
(4)正四面体
(5)MnO2+e-+H2O===MnOOH+OH-
(6)K2O ![]()
【解析】A、B、C、D、E、F、G七种元素,它们的原子序数依次增大。A在所有元素中原子半径最小,则A为H元素;B原子核外电子有6种不同运动状态,则B为C元素;E2-可能为O2-或S2-元素,A、D、E三种元素的原子序数之和为25,D和E的原子序数为24,根据原子序数的大小关系,则E为S元素,D为O元素,则C为N元素,E2-和F+有相同的核外电子排布,则F为K元素,G的质子数是25,G为Mn元素。
(1)根据构造原理,Mn的基态原子外围电子排布式为3d54s2;B、C、D三种元素分别形成的最简单的氢化物为:CH4、NH3、H2O,水在常温下为液态,CH4和NH3为气态,则H2O的沸点最高。
(2)O2与O3互为同素异形体,根据微粒中原子个数相同,价电子总数相同互为等电子体,可知O3与NO![]() 互为等电子体。
互为等电子体。
(3)在上述元素的原子中能形成非极性分子且为直线形的有CO2和HC≡CH,它们的电子式分别为![]() 和H∶CC∶H。
和H∶CC∶H。
(4)由4个N原子组成的不稳定单质分子为N4,由于N原子的杂化方式为sp3杂化,则M分子的立体构型是正四面体结构。
(5)该一次性电池负极材料是Zn,正极材料是MnO2,电解质为KOH,该电极的正极电极反应式为:MnO2+e-+H2O===MnOOH+OH-。
(6)上述元素中电负性最大的是O元素和第一电离能最小的K元素形成化合物N为K2O,由于r(K+)>r(Ca2+),故其晶格能小于CaO。由晶胞结构和均摊法知,每个晶胞中相当于含有4个K2O,则有:4×Mr(K2O)=NA·(a×10-10)3·ρ,该化合物的密度为:ρ=![]() g·cm-3。
g·cm-3。