题目内容
【题目】下图是部分短周期元素最外层电子数与原子序数的关系图。

请回答下列问题:
(1)画出Z的原子结构示意图__________________。
(2)原子半径:Y____Z(填“>”、“<”)。
(3)Y的最高价氧化物的水化物与氢氧化钠溶液反应的化学方程式为_________。
(4)X的最高价氧化物的水化物的化学式为_________。
(5)画出W的氢化物的电子式____________。
【答案】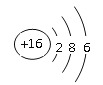 >Al(OH)3+NaOH=NaAlO2+2H2OHNO3
>Al(OH)3+NaOH=NaAlO2+2H2OHNO3![]()
【解析】由表中化合价可知,X的最外层电子数为5,故X为N元素,同样可判断Y为Al、Z为S、W为Cl;
(1)S的原子结构示意图为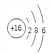 ;
;
(2)同周期主族元素的原子半径随核电荷增大而减小,则Al的原子半径比S大;
(3)Al(OH)3与氢氧化钠溶液反应的化学方程式为Al(OH)3+NaOH=NaAlO2+2H2O ;
(4)N的最高价氧化物的水化物为硝酸,其化学式为HNO3;
(5)HCl是共价化合物,其电子为式![]() 。
。

练习册系列答案
相关题目