题目内容
5.用NA表示阿伏加德罗常数.下列说法正确的是( )| A. | 同温同压同体积的气体单质所含原子个数相等 | |
| B. | 常温常压下,11.2LO2所含的氧原子数为NA | |
| C. | 摩尔是沟通宏观和微观的桥梁 | |
| D. | 大规模海水淡化采用蒸馏法 |
分析 A、气体单质分为单原子分子、双原子分子和多原子分子;
B、常温常压下,气体摩尔体积大于22.4L/mol;
C、物质的量是用来衡量微观离子集合体的一个物理量;
D、蒸馏法是海水淡化的方法之一.
解答 解:A、故同温同压同体积的单质气体的物质的量相同,但由于气体单质分为单原子分子、双原子分子和多原子分子,故含有的原子个数不一定相同,故A错误;
B、常温常压下,气体摩尔体积大于22.4L/mol,故11.2L氧气的物质的量小于0.5mol,含有的氧原子的个数小于NA个,故B错误;
C、物质的量是用来衡量微观离子集合体的一个物理量,是沟通宏观和微观的桥梁,摩尔只是物质的量的单位,故C错误;
D、可以利用蒸馏法将海水淡化为可饮用的水,蒸馏法是海水淡化的主要的方法,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算和海水的淡化方法,蒸馏法是目前海水淡化的最成熟的方法.

练习册系列答案
相关题目
16.在一定条件下化学反应:2SO2(g)+O2(g)═2SO3(g)△H=-197kJ/mol 现有容积相同且固定不变的甲、乙、丙三个容器,在上述条件下分别充入的气体和反应放出的热量(Q)如下表所列:
根据以上数据,下列叙述不正确的是( )
| 容器 | SO2(mol) | O2(mol) | N2(mol) | Q(kJ) |
| 甲 | 2 | 1 | 0 | Q1 |
| 乙 | 1 | 0.5 | 0 | Q2 |
| 丙 | 1 | 0.5 | 1 | Q3 |
| A. | Q2=Q3<98.5kJ | |
| B. | Q1=2Q2=2Q3=197kJ | |
| C. | 2Q2=2Q3<Q1<197kJ | |
| D. | 在上述条件下反应生成1molSO3气体放热98.5kJ |
13.我国规定食盐的含碘量(按每千克食盐含碘元素计)为20~40mg/Kg,则每千克食盐中加入碘酸钾的物质的量应不少于(设碘酸钾的摩尔质量为M g/mol)( )
| A. | $\frac{20×1{0}^{-3}}{127}$mol | B. | 20M mol | C. | $\frac{20×1{0}^{-3}}{M}$mol | D. | $\frac{20}{M}$mol |
20.如果1g O2中含有x个氧分子,则阿伏加德罗常数是( )
| A. | 32 x | B. | 32 x mol-1 | C. | 16 x | D. | 16 x mol-1 |
17.纯水在80℃时的pH( )
| A. | 等于7 | B. | 大于7 | C. | 小于7 | D. | 无法确定 |
6.Ⅰ.(1)已知某有机物A只含有C、H、O三种元素,通过元素分析知含碳54.55%,含氢9.10%.质谱分析其相对分子质量为88,经红外光谱分析其中只含C-H键和 键,其核磁共振氢谱图显示有三重峰,峰面积之比为3:2:3,该有机物不含有CH3-O-,则A的结构简式为CH3COOCH2CH3.
键,其核磁共振氢谱图显示有三重峰,峰面积之比为3:2:3,该有机物不含有CH3-O-,则A的结构简式为CH3COOCH2CH3.
(2)写出实验室制备A的化学方程式CH3COOH+HOCH2CH3$\stackrel{浓硫酸}{?}$CH3COOCH2CH3+H2O.
Ⅱ.苯甲酸甲酯 是常用香精,广泛用于食品、化妆品等行业,可从自然界中提取,也可人工合成.实验室现以食品防腐剂[主要成分为苯甲酸钠(
是常用香精,广泛用于食品、化妆品等行业,可从自然界中提取,也可人工合成.实验室现以食品防腐剂[主要成分为苯甲酸钠(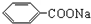 )]、甲醇为原料制备苯甲酸甲酯.已知:
)]、甲醇为原料制备苯甲酸甲酯.已知:
合成苯甲酸甲酯的流程如下:

请回答下列问题:
(1)温度①约为64.7℃,操作③为分液,操作④为蒸馏.
(2)第②步加热的目的是蒸出过量的甲醇.
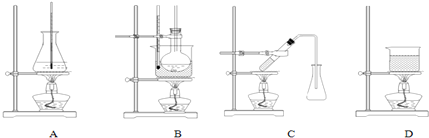
(3)选择合适的制备苯甲酸甲酯的装置:B.
(4)苯甲酸甲酯有多种同分异构体,写出符合下列条件的任意一种同分异构体的结构简式 .
.
①为芳香化合物 ②含有醛基 ③能与金属Na反应.
 键,其核磁共振氢谱图显示有三重峰,峰面积之比为3:2:3,该有机物不含有CH3-O-,则A的结构简式为CH3COOCH2CH3.
键,其核磁共振氢谱图显示有三重峰,峰面积之比为3:2:3,该有机物不含有CH3-O-,则A的结构简式为CH3COOCH2CH3.(2)写出实验室制备A的化学方程式CH3COOH+HOCH2CH3$\stackrel{浓硫酸}{?}$CH3COOCH2CH3+H2O.
Ⅱ.苯甲酸甲酯
 是常用香精,广泛用于食品、化妆品等行业,可从自然界中提取,也可人工合成.实验室现以食品防腐剂[主要成分为苯甲酸钠(
是常用香精,广泛用于食品、化妆品等行业,可从自然界中提取,也可人工合成.实验室现以食品防腐剂[主要成分为苯甲酸钠( )]、甲醇为原料制备苯甲酸甲酯.已知:
)]、甲醇为原料制备苯甲酸甲酯.已知:| 熔点℃ | 沸点℃ | 水溶性 | |
| 甲醇 | -97.8 | 64.7 | 易溶 |
| 苯甲酸 (一元弱酸) | 122.4 | 249.3 | 常温:0.17g 100℃:6.8g |
| 苯甲酸甲酯 | -12.3 | 198 | 难溶 |

请回答下列问题:
(1)温度①约为64.7℃,操作③为分液,操作④为蒸馏.
(2)第②步加热的目的是蒸出过量的甲醇.
(3)选择合适的制备苯甲酸甲酯的装置:B.

(4)苯甲酸甲酯有多种同分异构体,写出符合下列条件的任意一种同分异构体的结构简式
 .
.①为芳香化合物 ②含有醛基 ③能与金属Na反应.
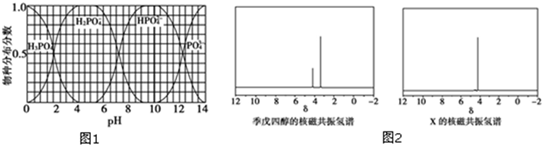
 )与季戊四醇(
)与季戊四醇(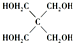 )以物质的量之比2:1 反应
)以物质的量之比2:1 反应 .
.