题目内容
16.在一定条件下化学反应:2SO2(g)+O2(g)═2SO3(g)△H=-197kJ/mol 现有容积相同且固定不变的甲、乙、丙三个容器,在上述条件下分别充入的气体和反应放出的热量(Q)如下表所列:| 容器 | SO2(mol) | O2(mol) | N2(mol) | Q(kJ) |
| 甲 | 2 | 1 | 0 | Q1 |
| 乙 | 1 | 0.5 | 0 | Q2 |
| 丙 | 1 | 0.5 | 1 | Q3 |
| A. | Q2=Q3<98.5kJ | |
| B. | Q1=2Q2=2Q3=197kJ | |
| C. | 2Q2=2Q3<Q1<197kJ | |
| D. | 在上述条件下反应生成1molSO3气体放热98.5kJ |
分析 2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol,反应热表示完全转化时放出的热量;
乙、丙两个容器容积相同,所充气体物质的量相同,丙中所充氮气对平衡无影响,所以乙、丙建立等效平衡,二氧化硫转化率相同,放出的热量相等;
甲、乙两个容器容积相同,甲中相应物质的物质的量为乙中2倍,压强比乙中高,相对乙平衡而言甲中平衡右移,二氧化硫转化率增大,所以甲中放出的热量大于乙甲中的2倍,结合可逆反应不能完全反应判断.
解答 解:A.乙、丙两个容器容积相同,所充气体物质的量相同,丙中所充氮气对平衡无影响,所以乙、丙建立等效平衡,二氧化硫转化率相同,放出的热量相等,但都不能反应到底,所以Q2=Q3<$\frac{197}{2}$=98.5kJ,故A正确;
B.乙、丙两个容器容积相同,所充气体物质的量相同,丙中所充氮气对平衡无影响,所以乙、丙建立等效平衡,二氧化硫转化率相同,Q2=Q3;甲、乙两个容器容积相同,甲中相应物质的物质的量为乙中2倍,压强比乙中高,相对乙平衡而言甲中平衡右移,二氧化硫转化率增大,所以甲中放出的热量大于乙甲中的2倍,可逆反应不能完全反应,故2Q2<Q1<197kJ,综上所述所述,2Q2=2Q3<Q1<197kJ,故B错误;
C.由B中分析可知,2Q2=2Q3<Q1<197kJ,故C正确;
D.2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol,反应热表示完全转化时放出的热量,所以生成1molSO3气体放热$\frac{197}{2}$=98.5kJ,故D正确;
故选B.
点评 本题考查反应热的计算、等效平衡、化学平衡计算等,题目难度中等,本题注意浓度对平衡的影响以及可逆反应的特征.

练习册系列答案
相关题目
4.下列叙述正确的是(NA为阿伏加德罗常数的数值)( )
| A. | 22.4LCO2含有NA个CO2分子 | B. | 0.1NA个H2SO4分子的质量为9.8克 | ||
| C. | 10gCaCO3含有NA个C原子 | D. | 2molCl2含有2NA个Cl原子 |
11.下列试剂可贮存在磨口试剂瓶的是( )
| A. | NaCl溶液 | B. | Na2SiO3溶液 | C. | 氢氟酸 | D. | NaOH溶液 |
1.下列各项反应对应的图象正确的是( )
| A. |  25℃时,向亚硫酸溶液中通入氯气 | B. |  向 Na[Al(OH)4]溶液中通入 HCl气体 | ||
| C. | 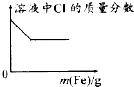 向少量氯化铁溶液中加入铁粉 | D. | 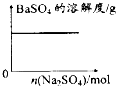 向BaSO4饱和溶液中加入硫酸钠 |
8.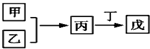 甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )
甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )
 甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )
甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )| A. | 若甲既能与盐酸反应又能与NaOH溶液反应,则丙可能属于两性氧化物 | |
| B. | 若丙、丁混合产生白烟,且丙为18电子分子,则乙的水溶液可能具有漂白作用 | |
| C. | 若甲、丙、戊含有同一种元素,该元素的化合价由低到高的顺序可能为甲<丙<戊 | |
| D. | 若甲为短周期中原子半径最大的主族元素的单质,且戊为碱,则丙只能为Na2O2 |
5.用NA表示阿伏加德罗常数.下列说法正确的是( )
| A. | 同温同压同体积的气体单质所含原子个数相等 | |
| B. | 常温常压下,11.2LO2所含的氧原子数为NA | |
| C. | 摩尔是沟通宏观和微观的桥梁 | |
| D. | 大规模海水淡化采用蒸馏法 |
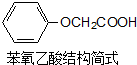 菠萝酯是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸发生酯化反应的产物.
菠萝酯是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸发生酯化反应的产物.  .
.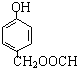 .
.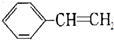 制取 聚苯乙烯
制取 聚苯乙烯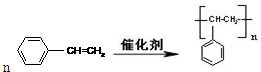 .
.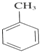 +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$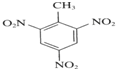 +3H2O.
+3H2O.