题目内容
13.我国规定食盐的含碘量(按每千克食盐含碘元素计)为20~40mg/Kg,则每千克食盐中加入碘酸钾的物质的量应不少于(设碘酸钾的摩尔质量为M g/mol)( )| A. | $\frac{20×1{0}^{-3}}{127}$mol | B. | 20M mol | C. | $\frac{20×1{0}^{-3}}{M}$mol | D. | $\frac{20}{M}$mol |
分析 1kg食盐中至少含碘元素20mg,根据n=$\frac{m}{M}$计算I元素物质的量,再根据I元素守恒确定每千克食盐加入碘酸钾(KIO3)的物质的量.
解答 解:1kg食盐中至少含碘元素20mg,即含Ⅰ物质的量为$\frac{20×1{0}^{-3}}{127}$mol,故每千克食盐中n(KIO3)=n(I)=$\frac{20×1{0}^{-3}}{127}$mol,
故选A.
点评 本题考查物质的量有关计算,比较基础,注意对公式的理解与灵活应用.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
3.化学与日常生活紧密相关,下列说法错误的是( )
| A. | 氮肥NH4NO3在重力撞击下可能发生爆炸 | |
| B. | 在食品袋中放入盛有硅胶的透气小袋,可防止食物受潮 | |
| C. | 二氧化硅可用于制备太阳能电池板,晶体硅可用于制作光导纤维 | |
| D. | 碳酸氢钠可用来治疗胃酸过多 |
4.下列叙述正确的是(NA为阿伏加德罗常数的数值)( )
| A. | 22.4LCO2含有NA个CO2分子 | B. | 0.1NA个H2SO4分子的质量为9.8克 | ||
| C. | 10gCaCO3含有NA个C原子 | D. | 2molCl2含有2NA个Cl原子 |
1.下列各项反应对应的图象正确的是( )
| A. |  25℃时,向亚硫酸溶液中通入氯气 | B. |  向 Na[Al(OH)4]溶液中通入 HCl气体 | ||
| C. |  向少量氯化铁溶液中加入铁粉 | D. |  向BaSO4饱和溶液中加入硫酸钠 |
8. 甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )
甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )
 甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )
甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )| A. | 若甲既能与盐酸反应又能与NaOH溶液反应,则丙可能属于两性氧化物 | |
| B. | 若丙、丁混合产生白烟,且丙为18电子分子,则乙的水溶液可能具有漂白作用 | |
| C. | 若甲、丙、戊含有同一种元素,该元素的化合价由低到高的顺序可能为甲<丙<戊 | |
| D. | 若甲为短周期中原子半径最大的主族元素的单质,且戊为碱,则丙只能为Na2O2 |
18.在容量瓶上须要标记的是( )
| A. | 刻度线 | B. | 温度 | C. | 浓度 | D. | 容量 |
5.用NA表示阿伏加德罗常数.下列说法正确的是( )
| A. | 同温同压同体积的气体单质所含原子个数相等 | |
| B. | 常温常压下,11.2LO2所含的氧原子数为NA | |
| C. | 摩尔是沟通宏观和微观的桥梁 | |
| D. | 大规模海水淡化采用蒸馏法 |
2.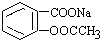 转变为
转变为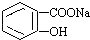 的方法是( )
的方法是( )
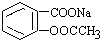 转变为
转变为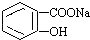 的方法是( )
的方法是( )| A. | 与足量Na0H溶液共热后,再通入CO2 | |
| B. | 溶液加热,通入足量的SO2 | |
| C. | 与稀硫酸共热后,加入足量Na0H溶液 | |
| D. | 足量稀硫酸共热后,加入足量NaHCO3 |
 在25℃,101KPa的条件下,将共8L的CO和O2的混合气体通入一个带可自由移动活塞容积可变但压强不变的密闭容器中(如图所示),用电火花点燃充分反应后恢复至原来的条件,测得气体的密度变为原来的$\frac{4}{3}$,求
在25℃,101KPa的条件下,将共8L的CO和O2的混合气体通入一个带可自由移动活塞容积可变但压强不变的密闭容器中(如图所示),用电火花点燃充分反应后恢复至原来的条件,测得气体的密度变为原来的$\frac{4}{3}$,求