题目内容
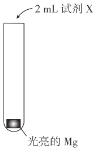
【题目】实验小组研究Mg与NH4Cl溶液的反应,实验如下:
| 实验 | 试剂X | 现象 |
Ⅰ | H2O | 产生极少气泡,Mg表面逐渐变暗,反应很快停止 | |
Ⅱ | 1mol/LNH4Cl溶液(pH=5) | 数分钟内持续产生较多气泡(经检验含有H2),溶液中出现大量白色固体,试管变热 |
(1)Ⅰ中Mg表面变暗,说明产生了Mg(OH)2固体。反应很快停止的原因是__。
(2)探究实验Ⅰ、Ⅱ产生气泡差异的原因。
假设一:NH4Cl溶液显酸性,c(H+)较大,与Mg反应速率较快。
①用离子方程式表示NH4Cl溶液显酸性的原因:___。
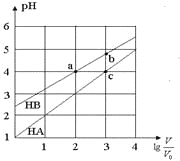
测定实验Ⅱ反应过程中溶液pH随时间的变化,结果如下:
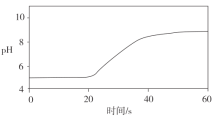
②假设一__(填“是”或“不是”)实验Ⅰ、Ⅱ产生气泡差异的主要原因。
假设二:NH4Cl溶液中的NH![]() 溶解Mg(OH)2固体,使Mg能够持续与水反应。
溶解Mg(OH)2固体,使Mg能够持续与水反应。
进行实验:向1mol/LNH4Cl溶液中加几滴氨水,使溶液pH≈8,得到溶液a。向少量Mg(OH)2固体中加入2mL溶液a,固体溶解。
③有同学认为假设二的实验不严谨,需增加对比实验:__(填操作和现象),说明假设二正确。
④向NH4Cl溶液中加几滴氨水的目的是___。
(3)1min后,实验Ⅱ中还检测到少量NH3。
①检测NH3时要使用湿润的___试纸。
②气体中含有少量NH3的原因是__。
(4)Mg与NH4Cl溶液充分反应后,仍有大量Mg(OH)2固体生成。综合上述实验,解释Mg与NH4Cl溶液的反应比Mg与H2O的反应更剧烈的主要原因:__。
【答案】生成的Mg(OH)2覆盖在Mg表面,使Mg与水接触面积减小,反应很快停止 NH![]() +H2O
+H2O![]() NH3H2O+H+ 不是 向1mol/LNaOH溶液中加几滴氨水,使溶液pH≈8,得到溶液b。向少量Mg(OH)2固体中加入2mL溶液b,固体不溶解 排除H+的影响,同时使c(NH
NH3H2O+H+ 不是 向1mol/LNaOH溶液中加几滴氨水,使溶液pH≈8,得到溶液b。向少量Mg(OH)2固体中加入2mL溶液b,固体不溶解 排除H+的影响,同时使c(NH![]() )基本不变 红色石蕊 随着反应2NH
)基本不变 红色石蕊 随着反应2NH![]() +Mg(OH)2=Mg2++2NH3H2O的进行,c(NH3H2O)逐渐增大,且反应放热,NH3H2O分解产生NH3 NH
+Mg(OH)2=Mg2++2NH3H2O的进行,c(NH3H2O)逐渐增大,且反应放热,NH3H2O分解产生NH3 NH![]() 可以促进Mg(OH)2的溶解平衡正向移动,2NH
可以促进Mg(OH)2的溶解平衡正向移动,2NH![]() +Mg(OH)2=Mg2++2NH3H2O,减少Mg(OH)2的覆盖,使Mg与水持续反应;反应放热,温度升高,反应速率加快
+Mg(OH)2=Mg2++2NH3H2O,减少Mg(OH)2的覆盖,使Mg与水持续反应;反应放热,温度升高,反应速率加快
【解析】
(1)Ⅰ中Mg表面变暗,说明产生了Mg(OH)2固体。而氢氧化镁不溶于水,会覆盖在镁单质的表面,减少了镁与水的接触面积,从而使反应速率减慢并停止,故答案为:生成的Mg(OH)2覆盖在Mg表面,使Mg与水接触面积减小,反应很快停止;
(2)①NH4Cl溶液显酸性是因铵根离子能发生水解反应产生氢离子,反应为:NH![]() +H2ONH3H2O+H+,故答案为:NH
+H2ONH3H2O+H+,故答案为:NH![]() +H2ONH3H2O+H+;
+H2ONH3H2O+H+;
②根据反应过程中的pH值变化曲线,若假设一是实验I、II产生差异的原因的话,因此起始时氯化铵的浓度最大,水解产生的氢离子浓度最大,开始阶段的反应速率应比较大,则开始阶段pH值应出现明显变化,这与图像不符合,因此假设一不是实验Ⅰ、Ⅱ产生气泡差异的主要原因,故答案为:不是;
③假设二的实验操作中不能说明是铵根离子还是氢氧根离子对氢氧化镁产生了影响,应补充对照实验,排除氢氧根离子对沉淀的影响,具体操作:在其他条件相同时,向1mol/LNaOH溶液中加几滴氨水,使溶液pH≈8,得到溶液b。向少量Mg(OH)2固体中加入2mL溶液b,固体不溶解,故答案为:向1mol/LNaOH溶液中加几滴氨水,使溶液pH≈8,得到溶液b。向少量Mg(OH)2固体中加入2mL溶液b,固体不溶解;
④向NH4Cl溶液中加几滴氨水是溶液呈碱性,这样可以在确保铵根浓度不变的情况下,排除氢离子的影响,故答案为:排除H+的影响,同时使c(NH![]() )基本不变;
)基本不变;
(3)①检测NH3一般用湿润的红色石蕊试纸,看试纸是否变蓝,故答案为:红色石蕊;
②随着反应2NH![]() +Mg(OH)2=Mg2++2NH3H2O的进行,c(NH3H2O)逐渐增大,且反应放热,NH3H2O分解产生NH3,导致气体中含有少量NH3,故答案为:随着反应2NH
+Mg(OH)2=Mg2++2NH3H2O的进行,c(NH3H2O)逐渐增大,且反应放热,NH3H2O分解产生NH3,导致气体中含有少量NH3,故答案为:随着反应2NH![]() +Mg(OH)2=Mg2++2NH3H2O的进行,c(NH3H2O)逐渐增大,且反应放热,NH3H2O分解产生NH3;
+Mg(OH)2=Mg2++2NH3H2O的进行,c(NH3H2O)逐渐增大,且反应放热,NH3H2O分解产生NH3;
(4)Mg与NH4Cl溶液充分反应后,仍有大量Mg(OH)2固体生成。综合上述实验,Mg与NH4Cl溶液的反应比Mg与H2O的反应更剧烈的主要原因NH![]() 可以促进Mg(OH)2的溶解平衡正向移动,2NH
可以促进Mg(OH)2的溶解平衡正向移动,2NH![]() +Mg(OH)2=Mg2++2NH3H2O,减少Mg(OH)2的覆盖,使Mg与水持续反应;反应放热,温度升高,反应速率加快,故答案为:NH
+Mg(OH)2=Mg2++2NH3H2O,减少Mg(OH)2的覆盖,使Mg与水持续反应;反应放热,温度升高,反应速率加快,故答案为:NH![]() 可以促进Mg(OH)2的溶解平衡正向移动,2NH
可以促进Mg(OH)2的溶解平衡正向移动,2NH![]() +Mg(OH)2=Mg2++2NH3H2O,减少Mg(OH)2的覆盖,使Mg与水持续反应;反应放热,温度升高,反应速率加快;
+Mg(OH)2=Mg2++2NH3H2O,减少Mg(OH)2的覆盖,使Mg与水持续反应;反应放热,温度升高,反应速率加快;

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】初始温度为t ℃,向三个密闭的容器中按不同方式投入反应物,发生如下反应:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) ΔH=-116kJ·mol-1,测得反应的相关数据如下:
2Cl2(g)+2H2O(g) ΔH=-116kJ·mol-1,测得反应的相关数据如下:
容器 | 容器类型 | 初始体积 | 初始压强/Pa | 反应物投入量/mol | 平衡时Cl2的物质的量/mol | |||
HCl | O2 | Cl2 | H2O | |||||
I | 恒温恒容 | 1L |
| 4 | 1 | 0 | 0 | 1 |
II | 绝热恒容 | 1L | p2 | 0 | 0 | 2 | 2 | a |
III | 恒温恒压 | 2L | p3 | 8 | 2 | 0 | 0 | b |
下列说法正确的是( )
A.反应4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(l)的ΔH>-116 kJ·mol-1
2Cl2(g)+2H2O(l)的ΔH>-116 kJ·mol-1
B.a>1, b>2
C.p2=1.6×105Pa,p3=4×105Pa
D.若起始向容器Ⅰ中充入0.5 mol HCl、0.5 mol O2、0.5 mol Cl2和0.5 mol H2O,则反应向逆反应方向进行
【题目】羰基硫(COS)可用作粮食熏蒸剂,可由CO和H2S在一定条件下反应制得。在2L的密闭容器中发生反应CO(g)+H2S(g)![]() COS(g)+H2(g),有关数据如表所示:
COS(g)+H2(g),有关数据如表所示:
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(CO) | n(H2S) | n(CO) | ||
① | 150 | 10 | 10 | 7 |
② | 400 | 20 | 20 | 16 |
下列说法正确的是( )
A.②中CO的平衡转化率为80%
B.400℃时该反应的平衡常数K=![]()
C.该反应是吸热反应
D.①中反应10min达到平衡,0~10min的平均反应速率:v(CO)=0.3mol/(Lmin)