题目内容
为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题。
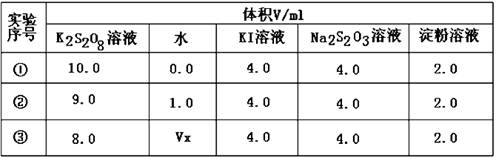
| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入5 mL 5% H2O2溶液,各滴入2滴1 mol/L FeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡。 | 试管A中不再产生气泡; 试管B中产生的气泡量增大。 |
| ② | 另取两支试管分别加入5 mL 5% H2O2溶液和5 mL 10% H2O2溶液 | 试管A、B中均未明显见到有气泡产生。 |
(1)过氧化氢分解的化学方程式为__________________________________________。
(2)实验①的目的是______________________________________________________。实验中滴加FeCl3溶液的目的是_________________________________________。
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是__________________________________(用实验中所提供的几种试剂)。
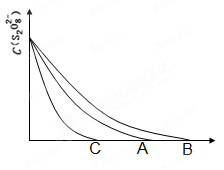
(4)某同学在50 mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如下图所示,则A、B、C三点所表示的瞬时反应速率最慢的是______________________。

(10分)(1)2H2O2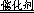 2H2O+O2↑(2分)
2H2O+O2↑(2分)
(2)研究温度对H2O2分解速率的影响(2分)
加快H2O2分解速率,使实验现象易于观察(2分)
(3)将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/LFeCl3溶液,观察产生气泡的速率(2分)
(4)C点的即时速率(2分)
解析试题分析:(1)过氧化氢不稳定,容易分解生成水和氧气,则2H2O2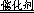 2H2O+O2↑;(2)实验①中过氧化氢的浓度和体积相同,氯化铁溶液的浓度和体积也相同,只有反应温度不同,分别是5℃、40℃,根据控制变量设计实验探究的规律,实验①的目的是研究温度对H2O2分解速率的影响;氯化铁溶液是双氧水分解反应的催化剂,实验中滴加氯化铁溶液的目的加快反应速率,,使实验现象易于观察;(3)实验②中过氧化氢溶液的体积相同,浓度不同,说明该实验的目的是研究浓度对双氧水分解速率的影响,因此其他条件相同即可,为了加快反应速率,便于观察实验现象,改进的方法可以是将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/LFeCl3溶液,观察产生气泡的速率;(4)随着反应的进行,双氧水的物质的量逐渐减小,其浓度逐渐减小;减小反应物浓度,反应速率减小,则图中A、B、C点所表示的双氧水浓度大小关系为:A>B>C,因此三点表示的瞬时反应速率大小顺序是A>B>C,所以C点所表示的反应速率最慢。
2H2O+O2↑;(2)实验①中过氧化氢的浓度和体积相同,氯化铁溶液的浓度和体积也相同,只有反应温度不同,分别是5℃、40℃,根据控制变量设计实验探究的规律,实验①的目的是研究温度对H2O2分解速率的影响;氯化铁溶液是双氧水分解反应的催化剂,实验中滴加氯化铁溶液的目的加快反应速率,,使实验现象易于观察;(3)实验②中过氧化氢溶液的体积相同,浓度不同,说明该实验的目的是研究浓度对双氧水分解速率的影响,因此其他条件相同即可,为了加快反应速率,便于观察实验现象,改进的方法可以是将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/LFeCl3溶液,观察产生气泡的速率;(4)随着反应的进行,双氧水的物质的量逐渐减小,其浓度逐渐减小;减小反应物浓度,反应速率减小,则图中A、B、C点所表示的双氧水浓度大小关系为:A>B>C,因此三点表示的瞬时反应速率大小顺序是A>B>C,所以C点所表示的反应速率最慢。
考点:考查探究实验,涉及过氧化氢分解反应的化学方程式、实验①的目的、滴加氯化铁溶液的目的、设计实验方案探究温度对过氧化氢分解速率的影响、设计实验方案探究浓度对过氧化氢分解速率的影响、化学反应速率图像、浓度对过氧化氢分解反应速率的影响规律的应用等。

氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟制备氨基甲酸铵,并探究其分解反应平衡常数。反应的化学方程式: 2NH3(g)+CO2(g) NH2COONH4(s)。请按要求回答下列问题:
NH2COONH4(s)。请按要求回答下列问题:
(1)请在下图1方框内画出用浓氨水与生石灰制取氨气的装置简图。
(2)制备氨基甲酸铵的装置如下图2所示。生成的氨基甲酸铵小晶体悬浮在四氯化碳中。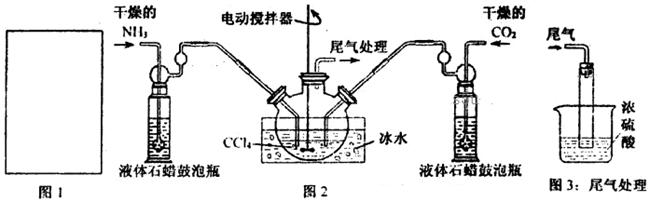
①从反应后的混合物中分离出产品的实验方法是_____________(填操作名称)。
②上图3中浓硫酸的作用是_______________________________________。
(3)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积
忽略不计),在恒定温度下使其达到分解平衡。实验测得不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
①下列选项可以判断该分解反应达到平衡的是________。
A.
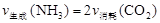
B.密闭容器内物质总质量不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②该分解反应的焓变ΔH______0(填“>”、“=”或“<”)。
25.0℃时的分解平衡常数的值=__________________________。
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量将_________(填“增加”,“减少”或“不变”)。
(4)图2中反应器用冰水冷却的原因是_____________________________________。
某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
(一)制取氧化铜
①称取2 gCuSO4·5H2O研细后倒入烧杯,加10 mL蒸馏水溶解;
②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀,然后将所得混合物加热至沉淀全部变为黑色;
③将步骤②所得混合物过滤、洗涤,晾干后研细备用。
回答下列问题:
(1)上述实验步骤中需要使用玻璃棒的是_______________(填实验序号),步骤②中加热所用仪器的名称是___________________;
(2)步骤③中洗涤沉淀的操作是___________________________________。
(二)证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较
用下图装置进行实验,实验时均以生成25 mL气体为准,其它可能影响实验的因素均已忽略,相关数据见下表: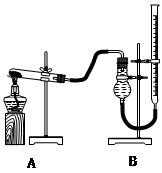
| 实验序号 | KClO3质量 | 其它物质质量 | 待测数据 |
| ④ | 1.2 g | 无其他物质 | |
| ⑤ | 1.2 g | CuO 0.5 g | |
| ⑥ | 1.2 g | MnO2 0.5 g | |
(3)上述实验中的“待测数”据指_____________;
(4)本实验装置图中量气装置B由干燥管、乳胶管和50 mL滴定管改造后组装而成,此处所用滴定管是___________(填“酸式”或“碱式”)滴定管;
(5)若要读取实验⑤中干燥管内收集的气体体积,应注意 ____________________
____________________________________________________;
⑹为探究CuO在实验⑤中是否起催化作用,需补做如下实验(无需写出具体操作):
a._______________________________,
b.CuO的化学性质有没有改变
(15分) 某同学设计了如下图所示装置(部分夹持装置已略去),该装置可以用来进行多项
实验研究。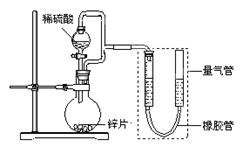
请回答:
(1)用上述装置探究影响化学反应速率的因素。
①圆底烧瓶中发生反应的离子方程式是 。
②用上述装置进行实验,以生成9.0 mL气体为计时终点,结果为t1>t2。
| 序号 | V(H2SO4)/mL | c(H2SO4)/mol·L-1 | t/s |
| Ⅰ | 40 | 1 | t1 |
| Ⅱ | 40 | 4 | t2 |
比较实验Ⅰ和Ⅱ可以得出的实验结论是 。
③若将锌片换成含杂质的粗锌片,且控制其他条件使其与上述实验完全一致,所测得的反应速率均大于上述实验对应的数据。粗锌片中所含杂质可能是(填序号) 。
a.石墨 b.银 c.铜 d.沙粒(二氧化硅)
(2)用上述装置测定粗锌片的纯度。
①连接好装置,检查装置气密性,称量粗锌片mg置于圆底烧瓶中,滴加足量稀硫酸,充分反应直至不再产生气体为止,测得气体体积为VL,则粗锌片的纯度为 。
②本实验在读数前对量气管的操作是 。
③本套装置中若考虑滴入的稀硫酸的体积(假设其它操作都正确),则测得的气体的体积将 。(填“偏大”、“偏小”或“无影响”,)
(3)用上述装置验证生铁在潮湿空气中会发生吸氧腐蚀。
①圆底烧瓶中的试剂可选用(填序号) 。
a.NH4Cl溶液 b.C2H5OH c.Na2CO3溶液 d.稀硫酸
②能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是 。
在25℃的条件下,下列叙述正确的是
A.将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO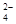 )= c(NH4+) )= c(NH4+) |
| B.pH=3的醋酸溶液,稀释至原体积的10倍后pH=4 |
| C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,溶液pH<7 |
| D.向0.1mol·L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-) 增大 |
一定温度时,向饱和的BaSO4溶液中加水,下列叙述正确的是
| A.BaSO4溶解度增大,Ksp不变 | B.BaSO4溶解度、Ksp均增大 |
| C.BaSO4溶解度不变,Ksp增大 | D.BaSO4溶解度、Ksp均不变 |
下列说法正确的是
| A.常温下,某溶液中由水电离出的c(H+)=1×10-amo1·L–1,若a<7时,则该溶液可能为NaHSO4溶液 |
| B.常温下,中和同体积、同pH的硫酸、盐酸和醋酸所需相同浓度的NaOH溶液的体积关系:V(硫酸)>V(盐酸)=V(醋酸) |
| C.25℃时,已知Ka(CH3COOH)=1.7×10-5mo1·L–1、Ka(C6H5OH) =1.0×10-10mo1·L–1、 Ka1(H2CO3) = 4.2×10-7mo1·L–1 、Ka2(H2CO3) =5.6×10-11mo1·L–1pH相等的①CH3COONa ②C6H5ONa ③NaHCO3溶液中,c(Na+)大小关系:②<③<① |
| D.常温下,向饱和Na2CO3溶液中加入少量BaSO4粉末,过滤,向洗净的沉淀中加入稀盐酸有气泡产生,说明常温下Ksp(BaSO4)>Ksp(BaCO3) |
 CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经测定该反应在该温度下的平衡常数K=1,试判断:
CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经测定该反应在该温度下的平衡常数K=1,试判断: