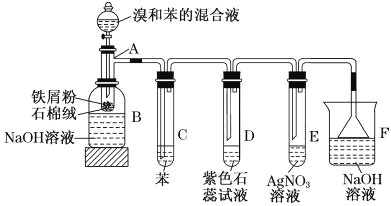
题目内容
【题目】SO2、NO是大气污染物,NH4NO3、H2SO4等是水体污染物,有效去除这些污染物是一项重要课题。
(1) NO、SO2可以先氧化,后用碱吸收。其氧化过程的反应原理如下:
NO(g)+O3(g)![]() NO2(g)+O2(g);ΔH1=-200.9 kJ·mol-1
NO2(g)+O2(g);ΔH1=-200.9 kJ·mol-1
SO2(g)+O3(g)![]() SO3(g)+O2(g);ΔH2=-241.6 kJ·mol-1
SO3(g)+O2(g);ΔH2=-241.6 kJ·mol-1
2SO2(g)+O2(g)![]() 2SO3(g);ΔH3=-196.6 kJ·mol-1
2SO3(g);ΔH3=-196.6 kJ·mol-1
则反应2NO2(g)![]() 2NO(g)+O2(g)的ΔH=____kJ·mol-1。
2NO(g)+O2(g)的ΔH=____kJ·mol-1。
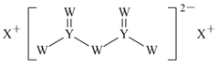
(2)土壤中的硫循环如图所示,土壤中的黄铁矿(FeS2)在过程Ⅰ中会转化成硫酸亚铁和硫酸,该过程发生的化学方程式为________________。
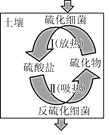
(3)电解法除去工业废水中的硝酸铵的装置示意图如图所示,阴极电极反应式为___。
(4)向恒容密闭容器中充入1 mol NO和2 mol O3,发生如下反应:NO(g)+O3(g)![]() NO2(g)+O2(g);ΔH<0。不同温度下反应相同时间后,体系中NO转化率随温度变化曲线如图。温度低于100℃时,NO转化率随温度升高而增大的主要原因是____;当温度高时,O3分解生成活性极高的氧原子,NO转化率随温度升高而降低,可能的原因有:①______,②______。
NO2(g)+O2(g);ΔH<0。不同温度下反应相同时间后,体系中NO转化率随温度变化曲线如图。温度低于100℃时,NO转化率随温度升高而增大的主要原因是____;当温度高时,O3分解生成活性极高的氧原子,NO转化率随温度升高而降低,可能的原因有:①______,②______。
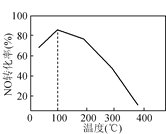
【答案】115.2 2FeS2+7O2+2H2O=2FeSO4+2H2SO4 2NH4++2e-=2NH3↑+H2↑ 低于100 ℃时,相同时间内反应未达到平衡。温度升高,化学反应速率加快,NO转化率高 温度高时,反应速率快,相同时间内已达到平衡,温度升高平衡左移 发生反应NO2+O=NO+O2
【解析】
(1)①已知NO(g)+O3(g)NO2(g)+O2(g)△H1=-200.9kJmol-1,②SO2(g)+O3(g)![]() SO3(g)+O2(g)△H2=-241.6kJmol-1,③2SO2(g)+O2(g)
SO3(g)+O2(g)△H2=-241.6kJmol-1,③2SO2(g)+O2(g)![]() 2SO3(g)△H3=-196.6kJmol-1,盖斯定律计算(②-①)×2得到反应2NO2(g)
2SO3(g)△H3=-196.6kJmol-1,盖斯定律计算(②-①)×2得到反应2NO2(g)![]() 2NO(g)+O2(g)的△H;
2NO(g)+O2(g)的△H;
(2)土壤中的黄铁矿(FeS2)在过程Ⅰ中和氧气、水反应会转化成硫酸亚铁和硫酸;
(3)装置图中放出氧气的为阳极,溶液中铵根离子在阴极得到电子生成混合气体为氨气和氢气;
(4)温度低于100℃时,NO转化率随温度升高而增大是反应速率增大,反应正向进行,已知温度高时,O3分解生成活性极高的氧原子,NO转化率随温度升高而降低,由于反应为放热反应,随温度升高平衡逆向进行,同时发生反应NO2+O=NO+O2使转化率降低。
(1)已知:①NO(g)+O3(g)NO2(g)+O2(g)△H1=-200.9kJmol-1,②SO2(g)+O3(g)![]() SO3(g)+O2(g)△H2=-241.6kJmol-1,③2SO2(g)+O2(g)
SO3(g)+O2(g)△H2=-241.6kJmol-1,③2SO2(g)+O2(g)![]() 2SO3(g)△H3=-196.6kJmol-1,盖斯定律计算(②-①)×2得到反应2NO2(g)
2SO3(g)△H3=-196.6kJmol-1,盖斯定律计算(②-①)×2得到反应2NO2(g)![]() 2NO(g)+O2(g)的△H=115.2kJ/mol;
2NO(g)+O2(g)的△H=115.2kJ/mol;
(2)土壤中的黄铁矿(FeS2)在过程Ⅰ中和氧气、水反应会转化成硫酸亚铁和硫酸,反应的化学方程式:2FeS2+7O2+2H2O=2FeSO4+2H2SO4;
(3)电解法除去工业废水中的硝酸铵是铵根离子得到电子生成氨气和氢气,电极反应:2NH4++2e-=2NH3↑+H2↑;
(4)温度低于100℃时,NO转化率随温度升高而增大的主要原因是:低于100°C,反应速率慢相同时间内还没有达到平衡状态,已知温度高时,O3分解生成活性极高的氧原子,NO转化率随温度升高而降低,可能的原因有:温度高时反应速率快,相同时间内已经达到平衡状态,由于反应为放热反应,随温度升高平衡逆向进行,同时发生反应NO2+O=NO+O2使转化率降低。

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】选择装置,完成实验。
|
|
|
|
① | ② | ③ | ④ |
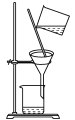
(1)喷泉实验,证明氨气极易溶于水,选用__(填序号,下同)。
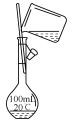
(2)配制100mL0.1mol·L-1NaOH溶液,选用__。
(3)鉴别Na2CO3和NaHCO3固体,选用__。
(4)用于分离泥沙与食盐溶液,选用__。
【题目】中科院一项最新成果实现了甲烷高效生产乙烯,甲烷在催化作用下脱氢,在气相中经自由基偶联反应生成乙烯,其反应如下: 2CH4(g) ![]() C2H4(g) +2H2(g) ΔH>0
C2H4(g) +2H2(g) ΔH>0
化学键 | H—H | C—H | C = C | C—C |
E(kJ / mol) | a | b | c | d |
(1)已知相关化学键的键能如上表,甲烷制备乙烯反应的ΔH=___________ (用含a.b.c.d的代数式表示)。
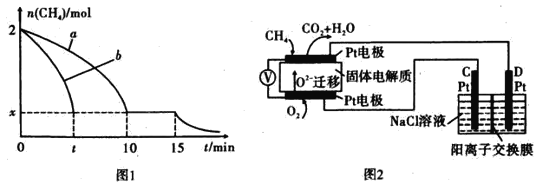
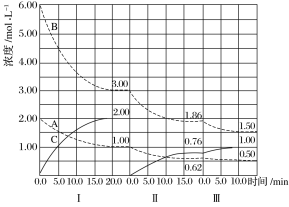
(2)T1温度时,向1 L的恒容反应器中充入2 molCH4 ,仅发生上述反应,反应过程中 0~15 min CH4的物质的量随时间变化如图1所示,测得10-15 min时H2的浓度为1.6 mol/L。
①0~ 10 min内CH4表示的反应速率为____mol/(Lmin) o
②若图中曲线a、曲线b分别表示在温度T1时,使用质量相同但表面积不同的催化剂时,达到平衡过程中n (CH4)变化曲线,其中表示催化剂表面积较大的曲线是 ________ (填"a"或 “b”)。
③15 min时,若改变外界反应条件,导致n( CH4)发生图中所示变化,则改变的条件可能是_____(任答一条即可)。
(3)实验测得v正=k正c2(CH4),v逆=k逆c(C2H4).c2(H2) 其中K正、K逆为速率常数仅与温度有关,T1温度时k正与K逆的比值为______ (填数值)。若将温度由T1升高到T2,则反应速率增大的倍数V正 ____V逆(填“>”“=”或“<”),判断的理由是__________
(4)科研人员设计了甲烷燃料电池并用于电解。如图2所示,电解质是掺杂了 Y2O3与 ZrO2的固体,可在高温下传导O2-
①C极的Pt为_______ 极(选填“阳”或“阴” )。
②该电池工作时负极反应方程式为_____________________ 。
③用该电池电解饱和食盐水,一段时间后收集到标况下气体总体积为112 mL,则阴极区所得溶液c(OH—)=_______ (假设电解前后溶液的体积均为500 mL)。