题目内容
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是所有短周期主族元素中最大的,W的核外电子数与X、Z的最外层电子数之和相等,Y的原子序数是Z的最外层电子数的2倍,由W、X、Y三种元素形成的化合物M的结构如图所示。下列叙述正确的是( )
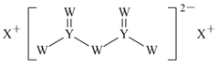
A.熔点:Y单质高于X单质
B.元素非金属性强弱的顺序为W>Y>Z
C.W的简单氢化物稳定性比Y的简单氢化物稳定性低
D.W分别与X、Y、Z形成的二元化合物均只有两种
【答案】A
【解析】
短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是所有短周期主族元素中最大的,X为Na元素;由W、X、Y三种元素形成的化合物M的结构分析,Y形成四个共价键,说明Y为Si元素;Y的原子序数是Z的最外层电子数的2倍,则Z为Cl元素;W的核外电子数与X、Z的最外层电子数之和相等,W为O元素;依此答题。
A. 单质Si为原子晶体,单质Na是金属晶体,单质Si的熔点高于单质Na,A正确;
B. W为O元素、Y为Si元素、Z为Cl元素,同周期,从左到右,非金属性增强;同主族,从上到下,非金属性减弱,O、Si、Cl三种元素非金属性强弱为:O>Cl>Si,B错误;
C. W为O元素、Y为Si元素,O的非金属性比Si强,所以O的氢化物的稳定性比Si的氢化物强,C错误;
D. W为O元素,与Si元素只能组成SiO2,D错误;
答案为A。

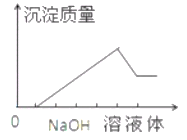
【题目】温度为T时,在两个起始容积都为1 L的恒温密闭容器发生反应:H2(g)+I2(g) ![]() 2HI(g) ΔH<0。实验测得:υ正=υ(H2)消耗=υ(I2)消耗=k正c(H2)·c(I2),υ逆=υ(HI)消耗=k逆c2(HI),k正、k逆为速率常数,受温度影响。下列说法正确的是
2HI(g) ΔH<0。实验测得:υ正=υ(H2)消耗=υ(I2)消耗=k正c(H2)·c(I2),υ逆=υ(HI)消耗=k逆c2(HI),k正、k逆为速率常数,受温度影响。下列说法正确的是
容器 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度 | ||
c(H2) | c(I2) | c(HI) | ||
Ⅰ(恒容) | 0.1 | 0.1 | 0 | c(I2)=0.07 mol·L-1 |
Ⅱ(恒压) | 0 | 0 | 0.6 | |
A.达平衡时,向容器Ⅰ中同时再通入0.1 mol I2和0.1 mol HI,则此时υ正>υ逆
B.两容器达平衡时:c(HI,容器Ⅱ)>3c(HI,容器Ⅰ)
C.反应过程中,容器Ⅰ与容器Ⅱ中的总压强之比为3∶1
D.温度一定,容器Ⅱ中反应达到平衡时(平衡常数为K),有K=![]() 成立
成立
【题目】一定条件下,2SO2(g)+O2(g)![]() 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2 mol SO2、 1 mol O2 | 4 mol SO3 | 2 mol SO2、 1 mol O2 |
平衡υ正(SO2)/mol·L-1·s-1 | v1 | v2 | v3 |
平衡c(SO3)/mol·L-1 | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的平衡转化率α | α1(SO2) | α2(SO3) | α3(SO2) |
平衡常数K | K1 | K2 | K3 |
下列说法正确的是
A.υ1<υ3,α1(SO2)>α3(SO2)
B.K1>K3,p2>2p3
C.c2>2c3,α2(SO3)+α3(SO2)>1
D.υ1<υ2,c2<2c1