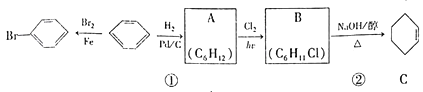
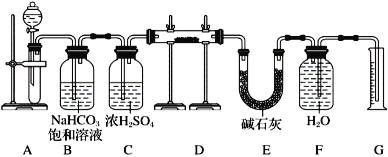
题目内容
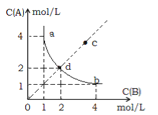
【题目】T℃时,在一固定容积的密闭容器中发生反应: A(g)+B(g)![]() C(s) △H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是
C(s) △H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是
A. T℃时,该反应的平衡常数![]()
B. c点没有达到平衡,此时反应向逆向进行
C. 若c点为平衡点,则此时容器内的温度高于T℃
D. T℃时,直线cd上的点均为平衡状态
【答案】C
【解析】A.由反应: A(g)+B(g) ![]() C(s)可知,C为固体,则T℃时,该反应的平衡常数K=
C(s)可知,C为固体,则T℃时,该反应的平衡常数K=![]() ,故A错误;B.据图可知,c点浓度商Qc<K,此时反应向正向进行,故B错误;C.若c点为平衡点,此时的平衡常数小于T℃时的平衡常数,说明平衡逆向移动,因A(g)+B(g)
,故A错误;B.据图可知,c点浓度商Qc<K,此时反应向正向进行,故B错误;C.若c点为平衡点,此时的平衡常数小于T℃时的平衡常数,说明平衡逆向移动,因A(g)+B(g) ![]() C(s)为放热反应,说明此时升高了温度,则容器内的温度高于T℃,故C正确;D. 平衡常数只与温度有关,T℃时平衡常数不变,曲线上的各点为平衡状态,其它点不是平衡状态,故D错误;答案选C。
C(s)为放热反应,说明此时升高了温度,则容器内的温度高于T℃,故C正确;D. 平衡常数只与温度有关,T℃时平衡常数不变,曲线上的各点为平衡状态,其它点不是平衡状态,故D错误;答案选C。

练习册系列答案
相关题目