题目内容
【题目】用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(气体体积已折算为标准状况下的体积)。下列分析正确的是( )
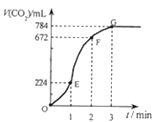
A. OE段表示的平均速率最快
B. EF段,用盐酸表示该反应的平均反应速率为 0.4mol/(L·min)
C. OE、EF、FG三段中,用二氧化碳表示该反应的平均反应速率之比为2:6:7
D. G点CO2不再增加的原因可能是盐酸已用完
【答案】BD
【解析】
A.曲线斜率表示化学反应速率快慢,斜率越大该阶段化学反应速率越大;
B.根据EF段生成二氧化碳的体积计算氯化氢的物质的量的变化量,进而计算氯化氢浓度变化,根据υ=△c/△t计算用盐酸表示该反应的平均反应速率;
C.各段终点与起点的纵坐标差值为各段生成的二氧化碳的体积,体积之比等于反应速率之比;
D.G点CO2不再增加的原因可能是盐酸浓度低,已用完。
A.斜率表示反应速率,斜率越大反应速率越大,由图可知,EF段斜率最大,所以EF段反应速率最大,故A错误;
B.由图可知EF段生成的二氧化碳的体积为672mL-224mL=448mL,所以二氧化碳的物质的量为0.448L÷22.4L·mol-1=0.02mol,根据CaCO3+2HCl═CaCl2+CO2↑+H2O,可知参加反应的氯化氢的物质的量为0.04mol,所以盐酸的浓度变化量为0.04mol÷0.1L=0.4mol·L-1,所以EF段用盐酸表示该反应的平均反应速率为0.4mol·L-1÷1min=0.4mol/(L·min),故B正确;
C.OE、EF、FG三段生成的二氧化碳体积分别为224mL、448mL、112mL,所以OE、EF、FG三段中,该反应用CO2表示的平均反应速率之比为224mL:448mL:112mL=2:4:1,故C错误;
D.G点表示收集的二氧化碳为从开始到G点生成的二氧化碳,总共784mL,G点CO2不再增加的原因可能是:盐酸浓度低,盐酸已经用完,故D正确;
故选BD。