题目内容
【题目】某新型锂空气二次电池放电情况如图所示,关于该电池的叙述正确的是 ( )
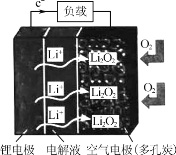
A. 电解液应选择可传递Li+的水溶液
B. 充电时,应将锂电极与电源负极相连
C. 放电时,空气电极上发生的电极反应为2Li++O2+2e-=Li2O2
D. 充电时,若电路中转移0.5 mol电子,空气电极的质量将减少3.5 g
【答案】BC
【解析】
在锂空气电池中,锂作负极,电极反应式为Li-e-=Li+,正极上是氧气得电子的还原反应,反应为2Li++O2+2e-═Li2O2。
A、Li是活泼金属,易与水反应,电解液不能选择可传递Li+的水溶液,故A错误;
B、充电时,电池的负极锂电极连接电源的负极,故B正确;
C、放电时,空气中的氧气在正极上得电子,发生还原反应,反应为2Li++O2+2e-═Li2O2,故C正确;
D、充电时,空气电极反应为Li2O2-2e-═2Li++O2,若电路中转移0.5 mol电子,空气电极的质量将减少0.25mol×46g/mol=11.5g,故D错误;
故选:BC。

【题目】下列实验操作对应的实验现象及解释或结论都正确的是( )
选项 | 实验操作 | 实验现象 | 解释或结论 |
A | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液 | 溶液变为黄色 | 氧化性:H2O2>Fe3+ |
B | 向5mL1mol/L NaOH溶液中滴加5滴1mol/L MgCl2溶液,然后再滴加足量的1mol/L CuCl2溶液 | 先产生白色沉淀,然后产生蓝色沉淀 | Ksp[Cu(OH)2] >Ksp[Mg(OH)2] |
C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 2NO2(g) |
D | 向一定量酸性KMnO4溶液中加入乙二醇(HOCH2CH2OH) | 溶液紫色褪去 | 乙二醇被氧化为乙二酸 |
A. A B. B C. C D. D