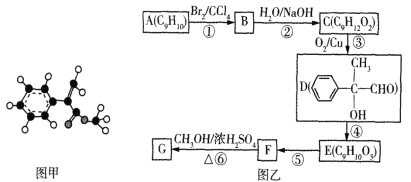
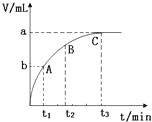
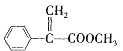题目内容
【题目】在36 g碳不完全燃烧所得气体中,CO占![]() 体积,CO2占
体积,CO2占![]() 体积,且C(s)+
体积,且C(s)+![]() O2(g) = CO(g) ΔH=—110.5 kJ/mol;CO(g)+
O2(g) = CO(g) ΔH=—110.5 kJ/mol;CO(g)+![]() O2(g) = CO2(g) ΔH=—283 kJ/mol。与这些碳完全燃烧相比,损失的热量是 ( )
O2(g) = CO2(g) ΔH=—283 kJ/mol。与这些碳完全燃烧相比,损失的热量是 ( )
A.172.5 kJB.110.5 kJC.283 kJD.566 kJ
【答案】D
【解析】
36g碳的物质的量为![]() =3mol,所以CO的物质的量为3mol×
=3mol,所以CO的物质的量为3mol×![]() =2mol,由于CO(g)+
=2mol,由于CO(g)+ ![]() O2(g)=CO2(g) △H=-283kJ/mol可知1molCO燃烧放出的热量为283kJ,即36g碳不完全燃烧生成2molCO损失的热量为2×283kJ=566 kJ。
O2(g)=CO2(g) △H=-283kJ/mol可知1molCO燃烧放出的热量为283kJ,即36g碳不完全燃烧生成2molCO损失的热量为2×283kJ=566 kJ。
答案选D。

 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案【题目】亚硝酰氯(ClNO)是有机物合成中的重要试剂,可由NO与Cl2在常温常压下反应得到。ClNO部分性质如下:黄色气体,熔点:-59.6℃,沸点:-6.4℃,遇水易水解。某研究性学习小组根据亚硝酰氯(ClNO)性质拟在通风橱中制取亚硝酰氯,设计了如下实验装置。、

试回答下列问题:
(1)写出实验室利用装置A制备Cl2的离子反应方程式___。
(2)装置B的作用是①__,②___。
(3)若用A装置制取NO气体,B中应该盛放__。
(4)为使NO和Cl2恰好完全反应生成ClNO,理论上向E中通入NO和Cl2两种气体的流速比为__。
(5)装置H吸收尾气,有同学认为尾气中的某种气体不能完全被吸收。为了充分吸收尾气,可将尾气与__同时通入NaOH溶液中。
(6)已知:ClNO与H2O反应生成HNO2和HCl。
①设计实验证明HNO2是弱酸:__。(仅提供的试剂:1molL-1HCl、1molL-1HNO2溶液、NaNO2溶液、红色石蕊试纸、蓝色石蕊试纸)。
②通过以下实验测定ClNO样品的纯度。取F中所得液体3.0g溶于水,配制成250mL溶液;取出25.00mL样品溶液置于锥形瓶中,用0.20molL-1AgNO3标准溶液滴定至终点,根据表中所给信息,应选用___做指示剂。
物质 | Ag2CrO4 | AgCl | AgI | Ag2S |
颜色 | 砖红色 | 白色 | 黄色 | 黑色 |
Ksp | 1×10-12 | 1.56×10-10 | 8.3×10-17 | 6.3×10-50 |
消耗标准AgNO3溶液的体积为20.00ml,亚硝酰氯(ClNO)的质量分数为__。