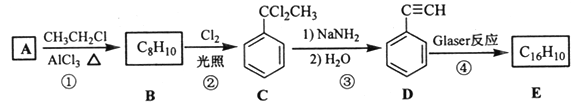
题目内容
【题目】下表是元素周期表的一部分,请参照元素①~⑦在表中的位置,回答下列问题:
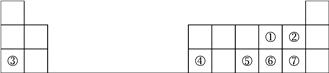
(1)①~⑦元素中原子半径最大的是__________(用元素符号表示);
(2)②⑦两种元素所形成的气态氢化物中最稳定的是__________(用化学式表示);
(3)⑤⑥两种元素最高价氧化物对应的水化物的酸性较强的是__________(用化学式表示);
(4)写出③④两种元素的最高价氧化物对应的水化物发生反应的离子方程式:_____________________________。
【答案】 Na HF H2SO4 Al(OH)3+OH-===AlO![]() +2H2O
+2H2O
【解析】根据元素在周期表中的位置知,①~⑦分别是O、F、Na、Al、P、S、Cl元素。(1)同周期从左到右元素的原子半径依次减小,同主族从上而下元素的原子半径依次增大,故①~⑦元素中原子半径最大的是Na;(2)元素F的非金属性强于Cl,故②⑦两种元素所形成的气态氢化物HF、HCl中最稳定的是HF;(3)元素非金属性越强,其最高价氧化物的水化物的酸性越强,故⑤⑥两种元素最高价氧化物对应的水化物磷酸和硫酸的酸性较强的是H2SO4;
(4)③④两种元素的最高价氧化物对应的水化物氢氧化钠和氢氧化铝发生反应的离子方程式为:Al(OH)3+OH-=AlO![]() +2H2O。
+2H2O。

 阅读快车系列答案
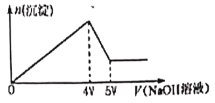
阅读快车系列答案【题目】某化学兴趣小组,通过下图装置进行硫酸与铜反应的实验探究。
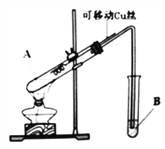
⑴提出假设:
假设一:加热时,稀H2SO4与Cu能反应。
假设二:加热时,浓H2SO4与Cu能反应。
⑵设计实验:
实验编号 | 实验操作 | 实验现象 |
1 | 将Cu丝与稀H2SO4接触,加热 | 试管B中溶液无明显变化 |
2 | 将Cu丝与浓H2SO4接触,加热 | 试管B中溶液褪色 |
实验前,试管B盛放的是_______________溶液(填“品红”或“酚酞”)。
⑶实验结论:通过以上实验,说明浓硫酸具有____________________(填写字母代号)。
A.强氧化性 B.脱水性 C.吸水性
⑷问题与计论:
①有同学认为该装置不完善,Cu与浓H2SO4反应生成了一种大气污染物,该气体是________;他建议在试管B口塞一团棉花,该棉花最好浸泡下列哪种溶液__________(填字母编号);
A.稀盐酸 B.NaOH溶液 C.NaCl溶液
②该兴趣小组在探究Cu与浓H2SO4反应时,将质量5.0g可移动Cu丝部分伸入浓H2SO4中,充分反应后,Cu丝剩余3.4g,将试管A中液体稀释成100ml溶液。该溶液中Cu2+物质的量浓度为_____mol·L-1 。
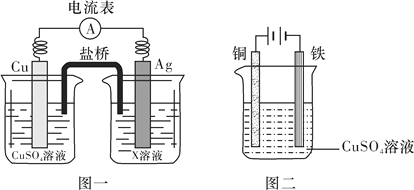
【题目】某校甲、乙两个化学小组学生利用下图所示装置进行“铁与水反应及相关性质”的实验。
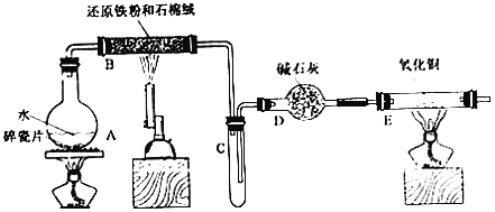
(1)装置B中发生反应的化学方程式是____________________________________。
(2)装置E中的现象是___________________________________________________。
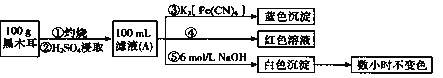
(3)将探究小组分为两组,按题图装置进行对比实验,甲组用洒精喷灯、乙组用洒精灯加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验。
步骤 | 操作 | 甲组现象 | 乙组现象 |
1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,无气泡 |
2 | 取少骤1中溶液,滴加酸性KMnO4溶液 | 紫色褪去 | 紫色褪去 |
3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
①乙组得到的黑色粉末是________________________。
②甲组步骤1中反应的离子方程式为______________________________________。
③乙组步骤4中,溶液变红的原因为____________________、___________________;(用离子方程式表示);溶液褪色可能的原因是_____________________________;验证方法为________________________________________。