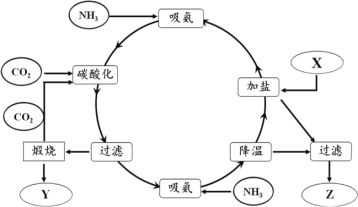
题目内容
【题目】在10 mL浓度均为0.1 mol/L的AlCl3与MgCl2混合溶液中,加入60 mL、0.1 mol/L的NaOH溶液后,铝元素的存在形式是
A.Al3+、Al(OH)3B.Al(OH)3C.![]() lO2-、Al(OH)3D.
lO2-、Al(OH)3D.![]() lO2-
lO2-
【答案】D
【解析】
氯化镁与氢氧化钠溶液反应的化学方程式为MgCl2+2NaOH═2NaCl+Mg(OH)2↓,10 mL 0.1 mol/L氯化镁溶液消耗氢氧化钠的物质的量为0.01L×0.1mol/L×2=2×10—3 mol,氯化铝与少量氢氧化钠溶液的化学方程式为AlCl3+3NaOH═3NaCl+Al(OH)3↓,10 mL 0.1 mol/L氯化铝溶液消耗氢氧化钠的物质的量为0.01L×0.1mol/L×3=3×10—3 mol,生成氢氧化铝的物质的量为1×10—3 mol,由题意可知过量的氢氧化钠的物质的量为(6×10—3 mol—5×10—3 mol)=1×10—3 mol,过量的氢氧化钠与氢氧化铝反应的化学方程式为Al(OH)3+NaOH=NaAlO2+2H2O,由方程式可知,1×10—3 mol氢氧化铝和1×10—3 mol氢氧化钠恰好完全反应生成偏铝酸钠,则完全反应后铝元素的存在形式是AlO2—,故选D。

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案
相关题目