题目内容
【题目】碳、氮能形成多种氧化物、氢化物。
(1)已知:①![]()
②![]()
则![]() 与
与![]() 反应生成两种无毒气体的热化学方程式为_____________。
反应生成两种无毒气体的热化学方程式为_____________。
(2)使用高效催化剂可大大减少汽车尾气排放出的![]() 含量,某研究所的科研人员探究了
含量,某研究所的科研人员探究了![]() 时等质量的三种催化剂对
时等质量的三种催化剂对![]() 还原
还原![]() 的催化效果(其他条件相同),所得结果如图所示:
的催化效果(其他条件相同),所得结果如图所示:
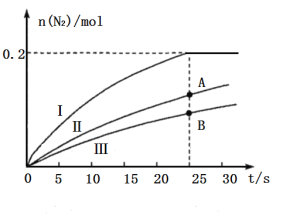
①如果不考虑催化剂价格,则使用催化剂______(填“Ⅰ”“Ⅱ”或“Ⅲ”)最好;A、B两状态下,生成![]() 的速率大小关系是___________。
的速率大小关系是___________。
②若容器容积为2L,开始时加入![]() 、
、![]() ,在催化剂Ⅰ的作用下达到如图所示平衡,则反应
,在催化剂Ⅰ的作用下达到如图所示平衡,则反应![]() 在该温度下的平衡常数
在该温度下的平衡常数![]() ______
______![]() 。
。
③在如图坐标系中画出使用催化剂Ⅰ(其他条件相同)时,25s时容器内反应的脱氮率(![]() 转化率)与温度的关系图___________。
转化率)与温度的关系图___________。
(3)化学动力学上将一步完成的反应称为基元反应。对于基元反应:![]() ,其速率方程式为
,其速率方程式为![]() (k为只与温度有关的速率常数),复杂反应(由几个基元反应构成)的速率取决于慢的基元反应。
(k为只与温度有关的速率常数),复杂反应(由几个基元反应构成)的速率取决于慢的基元反应。
①已知反应![]() ,在温度低于
,在温度低于![]() 时是由两个基元反应构成的复杂反应,该反应的速率方程式为
时是由两个基元反应构成的复杂反应,该反应的速率方程式为![]() ,则其两个基元反应分别为:Ⅰ.______
,则其两个基元反应分别为:Ⅰ.______![]() ______;Ⅱ.略,这两个反应中活化能较小的是__________。
______;Ⅱ.略,这两个反应中活化能较小的是__________。
②某科研小组测得![]() 时该反应的
时该反应的![]() 、
、![]() 生成
生成![]() 的速率
的速率![]() 的关系如下:
的关系如下:
| 0.025 | 0.05 | 0.025 |
| 0.04 | 0.04 | 0.12 |
|
|
|
|
则该温度下的反应速率常数![]() ______
______![]() 。
。
【答案】![]() Ⅰ
Ⅰ ![]() 640
640 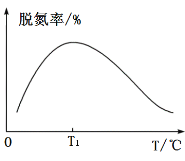
![]()
![]() Ⅱ 0.22
Ⅱ 0.22
【解析】
(1)根据盖斯定律进行求算;
(2)①由图1知,在相同时间内使用催化剂Ⅰ时生成的![]() 最多,故选用催化剂Ⅰ最好。由于使用催化剂Ⅱ的效果好于催化剂Ⅲ,即25s时A状态中
最多,故选用催化剂Ⅰ最好。由于使用催化剂Ⅱ的效果好于催化剂Ⅲ,即25s时A状态中![]() 、
、![]() 浓度比B状态的大,故A状态下逆反应速率较大,即生成
浓度比B状态的大,故A状态下逆反应速率较大,即生成![]() 的速率较大。②平衡时
的速率较大。②平衡时![]() ,
,![]() ,
,![]() ,故
,故![]() 。③相同时间内,在反应达到平衡状态前,反应速率越快,氮的去除率越高,达到平衡后,温度越高,越不利于反应向右进行,即氮的去除率降低,由此可作出相应的图像。
。③相同时间内,在反应达到平衡状态前,反应速率越快,氮的去除率越高,达到平衡后,温度越高,越不利于反应向右进行,即氮的去除率降低,由此可作出相应的图像。
(3)①由Ⅰ的![]() 知,反应物只有
知,反应物只有![]() 且化学计量数是2。Ⅰ是慢反应,则Ⅱ是快反应,活化能较小。②由表中数据知
且化学计量数是2。Ⅰ是慢反应,则Ⅱ是快反应,活化能较小。②由表中数据知![]() 时,该反应的反应速率与
时,该反应的反应速率与![]() 、
、![]() 的浓度成正比,即
的浓度成正比,即![]() ,由此可求出
,由此可求出![]() 。
。
(1) NO与CO反应生成两种无毒气体,应为CO2和N2,方程式应为2CO(g)+2NO(g) ![]() 2CO2(g)+N2(g);
2CO2(g)+N2(g);
由已知:①2NO(g) ![]() N2(g)+O2(g) △H1=-180.5 kJ·mol-1;
N2(g)+O2(g) △H1=-180.5 kJ·mol-1;
②CO(g)+![]() O2(g)
O2(g) ![]() CO2(g) △H2=-283 kJ·mol-1;
CO2(g) △H2=-283 kJ·mol-1;
根据盖斯定律可知①+②![]() 2可得2CO(g)+2NO(g)
2可得2CO(g)+2NO(g) ![]() 2CO2(g)+N2(g) △H=-180.5 kJ·mol-1+(-283 kJ·mol-1)=-746.5kJ kJ·mol-1;
2CO2(g)+N2(g) △H=-180.5 kJ·mol-1+(-283 kJ·mol-1)=-746.5kJ kJ·mol-1;
(2)①据图可知相同时间内使用催化剂I的反应最先达到平衡,所以使用催化剂I最好;据图可知A点曲线的斜率更大,反应速率更快,![]() ;
;
②据图可知25s时氮气的物质的量不再改变说明反应达到平衡,此时n(N2)=0.2mol,根据方程式可知此时容器中n(CO2)=0.4mol,△n(NO)=△n(CO)=0.4mol,初始投料为0.5molCO和0.5molNO,所以平衡时容器内n(NO)=n(CO)=0.1mol,容器的体积为2L,所以K=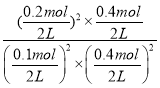 =640;
=640;
③温度低于T1时,反应速率小于T1时的反应速率,所以25s时反应达不到平衡,且温度越高反应速率越快,相同时间内脱氮率越高,当温度高于T1时,反应速率加快,则25s时反应达到平衡,但由于该反应正反应焓变小于0,为放热反应,所以温度升高,平衡左移,脱氮率会下降,所以关系图为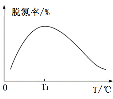 ;
;
(3)①温度低于250℃时,该反应的速率方程式为v=k·c2(NO2),说明NO2和CO不参与同一个基元反应,且NO2参与的基元反应为慢反应,决定了该反应的反应速率,基元反应I中产物有NO3,根据元素守恒可知该基元反应反应物应为NO2,则该基元反应I为:2NO2=NO3+NO; 活化能越大,反应速率越慢,基元反应I决定整个反应速率,说明反应I活化能较大,即反应II活化能较小;
②根据表格分析可知CO和NO2的浓度均会影响反应速率,由于该反应不是基元反应,可设该反应的正反应速率v=k·cx(NO2)·cy(CO),将表格中相应数据代入有
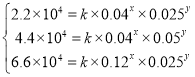
联立可解得x=1,y=1,k=0.22L·mol-1·s-1。

 阅读快车系列答案
阅读快车系列答案【题目】在100℃时,将0.200 mol的四氧化二氮气体充入2 L真空的密闭容器中,每隔一定的时间对该容器内的物质进行分析,得到如下表格:
| 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
试填空:
(1)该反应的化学方程式为N2O4![]() 2NO2 ,达到平衡时,四氧化二氮的转化率为__________%,表中c2________c3、a______b(填“>”、“<”或“=”)。
2NO2 ,达到平衡时,四氧化二氮的转化率为__________%,表中c2________c3、a______b(填“>”、“<”或“=”)。
(2) 20 s时四氧化二氮的浓度c1=________mol/L,在0 s~20 s时间段内,四氧化二氮的平均反应速率为________mol/(L·s)。
(3)若在相同情况下最初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度是________mol/L。