题目内容
【题目】已知下列热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1= -26.7kJ·mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2= -50.75kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3= -36.5 kJ·mol-1
则反应FeO(s)+CO(g)=Fe(s)+CO2(g)的焓变为
A.+7.28kJ·mol-1B.7.28kJ·mol-1
C.+43.68kJ·mol-1D.43.68kJ·mol-1
【答案】A
【解析】
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1= -26.7kJ·mol-1,②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2= -50.75kJ·mol-1,③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3= -36.5kJ·mol-1,根据盖斯定律,将①×3-②-③×2得:④6FeO(s)+6CO(g)═6Fe(s)+6CO2(g),再由④÷6得:FeO(s)+CO(g)═Fe(s)+CO2(g),故△H=![]() =
=![]() = +7.28kJ·mol-1,故选A。
= +7.28kJ·mol-1,故选A。

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案【题目】25℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO | |
电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 | |
回答下列问题:
(1)下列四种离子结合质子的能力由大到小的顺序是___;(填编号)
A.CO32- B.ClO- C.CH3COO- D.HCO3-
(2)下列反应不能发生的是___;
A.CO32-+CH3COOH=CH3COO-+CO2↑+H2O
B.ClO-+CH3COOH=CH3COO- +HClO
C.CO32-+HClO=CO2↑+H2O+ClO-
D.2ClO-+CO2+H2O=CO32-+2HClO
(3)用蒸馏水稀释0.10mol·L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是___;
A.c(CH3COOH)/c(H+)
B.c(CH3COO-)/c(CH3COOH)
C.c(H+)/Kw
D.c(H+)/c(OH-)
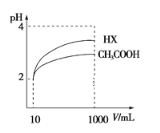
(4)体积为10 mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000 mL,稀释过程pH变化如图所示,则HX的电离平衡常数__(填“大于”、“等于”或“小于”)醋酸的平衡常数,稀释后,HX溶液中水电离出来的c(H+)___醋酸溶液中水电离出来的c(H+)。(填“大于”、“等于”或“小于”)