题目内容
【题目】能证明硫酸为强酸的实验事实是
A. 能与酸碱指示剂作用 B. 0.1mol/L的硫酸中,测得c(H+)=0.2mol/L
C. 能与金属锌反应生成氢气 D. 能与食盐固体共热产生气体氯化氢
【答案】B
【解析】
A.硫酸能与酸碱指示剂作用,只能说明硫酸具有酸性,不能说明硫酸是强酸,故A错误;
B.0.1mol/L的硫酸中,测得c(H+)=0.2mol/L,说明硫酸在水溶液中可以完全电离为离子,故硫酸为强酸,B正确;
C.硫酸能与金属锌反应生成氢气,只能证明硫酸具有酸的通性,不能说明硫酸是强酸,故C错误;
D.硫酸能与食盐固体共热产生气体氯化氢,只能证明硫酸是沸点比盐酸的沸点高的难挥发性酸,故D错误;
本题答案为B。

练习册系列答案
相关题目
【题目】下表是氧族部分元素的相关性质。
元素 性质 | 8O | 16S | 34Se | 52Te |
主要化合价 | -2 | -2、+4、+6 | -2、+4、+6 | |
原子半径 | 逐渐增大 | |||
单质与H2 反应情况 | 点燃时 易化合 | 加热 化合 | 加热 难化合 | 不能 直接化合 |
请回答下列问题:
(1)硒在周期表中位置____。
(2)碲的化合价可能有____。
(3)硫、硒、碲的氢化物水溶液的酸性由强至弱的顺序是__________(填化学式)。
(4)氢硒酸有较强的____(填“氧化性”或“还原性”),因此放在空气中易变质,其可能发生的化学方程式为_____________。
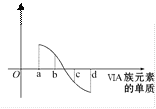
(5)氧族元素单质与H2反应过程中的焓变如图所示,其中a、b、c、d分别表示氧族中某一元素的单质。则b代表___,d代表___(均写单质名称)。