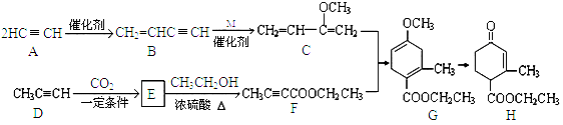��Ŀ����
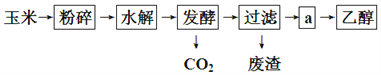
����Ŀ����������Ϊԭ������ȼ���Ҵ����������̿�����ͼ��ʾ��
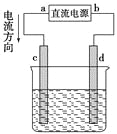
��1���Ҵ������������Ĺ����ŵ�����Ϊ��__________________��
��2�����˺�õ�a����Ҫ�ɷ�Ϊ�����Ǻ��Ҵ�������a�IJ�����__________��
A������ B����ȡ C������ D����Һ
��3������������Ϊ�˼���ˮ���Ƿ�ʼ����ʹ�õ��Լ���______________��
��4����֪1g�Ҵ���ȫȼ�շų�������Ϊ29.7kJ����ݴ�д���Ҵ�ȼ�յ��Ȼ�ѧ����ʽ��_______��
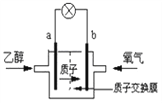
��5��Ϊ�˳�������Ҵ�����������ѧ�һ����Ҵ���Ƴ�ȼ�ϵ�أ���ͼ���û����������ܼ����ڸ��¹���ʱ���Ҵ����Ч�ʸ��Ҹ���ȫ�����жϣ��õ�ص�a��Ϊ��ص�_______�����������������b���ĵ缫��ӦʽΪ��____________________________����ع���ʱ������1mol�Ҵ�����������ת�Ƶĵ���Ϊ____________mol��
���𰸡� �ǻ� C ������Һ������Cu(OH)2����Һ C2H5OH(l) + 3O2(g) = 2CO2(g) + 3H2O(l) ��H = ��1366.2 kJ/mol �� O2 + 4H+ + 4e�� = 2H2O 12
����������1���Ҵ������������Ĺ����ŵ�����Ϊ���ǻ�����2�����˺�õ�a����Ҫ�ɷ�Ϊ�����Ǻ��Ҵ��������Ǻ��Ҵ����ܵ������л������������ǵķе㲻ͬ������������룬����a�IJ���������ѡC����3�������ۿ�ʼˮ��������������ǣ�������������Ϊ�˼���ˮ���Ƿ�ʼ����ʹ�õ��Լ���������Һ������Cu(OH)2����Һ����4����֪1g�Ҵ���ȫȼ�շų�������Ϊ29.7kJ����1mol�Ҵ�����Ϊ1mol��46g/mol=46g����ȫȼ�շų���ִ��Ϊ��46��29.7kJ=1366.2 kJ�����Ҵ�ȼ�յ��Ȼ�ѧ����ʽΪ��C2H5OH(l) + 3O2(g) = 2CO2(g) + 3H2O(l) ��H = ��1366.2 kJ/mol����5��ȼ�ϵ�ظ���ʧȥ���ӷ���������Ӧ����ͨ���Ҵ���a��Ϊ��صĸ�����b��Ϊ�������ڻ����������ܼ��������õ���ת��Ϊˮ�������缫��ӦʽΪ��O2 + 4H+ + 4e�� = 2H2O���Ҵ���������C2H5OH�е�̼��-2�۱�Ϊ+4�ۣ�������1mol�Ҵ�����������ת�Ƶĵ���Ϊ(2��6)mol=12mol��

 ��У����ϵ�д�
��У����ϵ�д�