题目内容
16.与0.1molH3PO4所含的氧原子数相同的是( )| A. | 0.1molH2SO4 | B. | 0.2molH2SO3 | C. | 0.2molSO3 | D. | 0.3molCO2 |
分析 0.1mol H3PO4所含O原子物质的量为0.4mol,由N=nNA可知,原子个数相同,则原子的物质的量相同,结合选项中各分子中氧原子数目计算含有氧原子物质的量.
解答 解:0.1mol H3PO4所含O原子物质的量为0.4mol,
A.0.1 mol H2SO4含有O原子为0.1mol×4=0.4mol原子,故A正确;
B.0.2 mol H2SO3含有O原子为0.2mol×3=0.6mol原子,故B错误;
C.0.2 mol SO3含有O原子为0.2mol×3=0.6mol原子,故C错误;
D.0.2 mol CO2含有O原子为0.2mol×2=0.4mol原子,故D错误,
故选A.
点评 本题考查物质的量的计算,涉及微粒数目有关计算,注意理解化学式的意义,难度不大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
6.由铜、锌和稀硫酸组成的原电池中,下列各叙述正确的是( )
| A. | 溶液pH由大变小 | B. | 负极附近Zn2+浓度逐渐增大 | ||
| C. | H+向负极移动 | D. | 溶液中H2SO4的浓度不变 |
7.下列事实中能说明亚硝酸(HNO2)是弱电解质的是( )
| A. | 0.1 mol•L-1的HNO2溶液中[H+]约为0.01 mol•L-1 | |
| B. | 用HNO2溶液做导电实验,灯泡很暗 | |
| C. | HNO2溶液不与Na2SO4溶液反应 | |
| D. | HNO2能与NaOH溶液发生中和反应 |
4.下列各组气体,在常温下能共存的是( )
| A. | NO和O2 | B. | NH3和HCl | C. | NH3和O2 | D. | H2S和SO2 |
11.标准状况下,1mol下列物质体积最大的是( )
| A. | Fe | B. | O2 | C. | H2O | D. | H2SO4 |
8.下列实验操作中,正确的是( )
| A. | 为了使过滤速度加快,可用玻璃棒在过滤器中轻轻搅拌,加速液体流动 | |
| B. | 燃着的酒精灯打翻失火,应立即用水浇灭 | |
| C. | 为加速固体物质的溶解,可采用粉碎、振荡、搅拌、加热等方法 | |
| D. | 为增大气体物质的溶解度,常采用搅拌、加热等措施 |
5.下列离子方程式书写不正确的是( )
| A. | 往NaOH溶液中通入过量CO2:CO2+OH-═HCO3- | |
| B. | 往水玻璃中加入盐酸:SiO32-+2H+═H2SiO3↓ | |
| C. | 石英砂与烧碱反应制水玻璃:SiO2+2OH-═SiO32-+H2O | |
| D. | 往水玻璃中通入CO2:Na2SiO3+H2O+CO2═H2SiO3+2Na++CO32- |
6.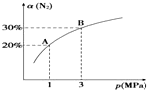 某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.N2的平衡转化率(α)与体系总压强(p)的关系如图所示.下列说法正确的是( )
某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.N2的平衡转化率(α)与体系总压强(p)的关系如图所示.下列说法正确的是( )
 某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.N2的平衡转化率(α)与体系总压强(p)的关系如图所示.下列说法正确的是( )
某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.N2的平衡转化率(α)与体系总压强(p)的关系如图所示.下列说法正确的是( )| A. | 将1 mol氮气、3 mol氢气,置于1 L密闭容器中发生反应,放出的热量为92.4 kJ | |
| B. | 平衡状态由A变到B时,平衡常数K(A)<K(B) | |
| C. | 上述反应在达到平衡后,增大压强,H2的转化率增大 | |
| D. | 升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小 |