题目内容
(11分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
|
周期 族 |
IA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
1 |
① |
|
|
|
|
|
|
|
|
2 |
|
|
|
② |
③ |
④ |
⑤ |
|
|
3 |
⑥ |
|
⑦ |
|
|
⑧ |
⑨ |
⑩ |
(1)非金属性最强的是 (填元素名称)、化学性质最不活泼的是__________。
(2)⑤的气态氢化物稳定性比⑨的气态氢化物________。(填“强”、“弱”或“相同”)
(3)②、③、⑨的最高价含氧酸的酸性由强到弱的顺序是_____________。(填化学式)
(4)可作为补钙产品成分之一的化学物质是_________;
A.CaO B.Ca(OH)2 C.CaCO3 D.Ca
(5)⑧的原子结构示意图为_________________,其气态低价氧化物通入___________溶液中,能使该溶液褪色,说明该氧化物具有 性。
(6)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被MnO2催化分解,写出反应的化学方程式 _______________________________________。
(7)我省有的地区都使用天然气作为燃料。天然气主要成分的结构式为 ,该物质中氢元素的质量分数为 。
(1)氟 、Ar
(2)强
(3)HClO4 > HNO3 > H2CO3
(4)C (5)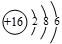 品红(或KMnO4溶液或溴水) 漂白(或还原)
品红(或KMnO4溶液或溴水) 漂白(或还原)
(6)2H2O2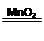 2H2O+O2↑ (7)
2H2O+O2↑ (7)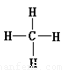 25%
25%
【解析】考查元素周期表的结构及元素周期律的应用。
(1)非金属性最强的是氟,化学性质最不活泼的是稀有气体元素Ar。
(2)非金属性越强,氢化物的稳定性越强,氟非金属性强于氯元素的,所以氟化氢的稳定性强于氯化氢的。
(3)非金属性越强,最高价氧化物的水化物的酸性越强,非金属性是Cl> N > C,所以HClO4 > HNO3 > H2CO3。
(4)可作为补钙产品成分之一的化学物质是碳酸钙,答案选C。
(5)⑧是S,原子结构示意图是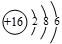 ,其低价氧化物是SO2,具有还原性,能使溴水或酸性高锰酸钾溶液褪色。
,其低价氧化物是SO2,具有还原性,能使溴水或酸性高锰酸钾溶液褪色。
(6)常见液态化合物的稀液易被MnO2催化分解的是双氧水,方程式为2H2O2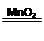 2H2O+O2↑。
2H2O+O2↑。
(7)天然气的主要成分是甲烷,结构式是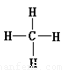 ,分子式为CH4,所以氢的含量是
,分子式为CH4,所以氢的含量是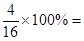 25%。
25%。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案







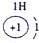
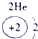
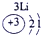
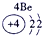
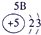
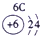
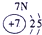
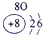
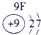
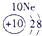
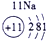





 表示的是
表示的是