题目内容
下表为元素周期表的一部分,请参照①~⑩在表中的位置,用化学用语回答下列问题:

(1)元素③形成的单质的电子式为
 ;元素②形成的最高价氧化物的结构式为
;元素②形成的最高价氧化物的结构式为
(2)⑥、⑦两元素的最高价氧化物的水化物之间反应的离子方程式为
(3)②、③、④、⑤元素形成的氢化物中,热稳定性最强的是
(4)⑧、⑨元素的最高价氧化物的水化物酸性强弱比较
(5)元素⑩在周期表中的位置

(1)元素③形成的单质的电子式为


O=C=O
O=C=O
.(2)⑥、⑦两元素的最高价氧化物的水化物之间反应的离子方程式为
Al(OH)3+OH-=AlO2-+2H2O
Al(OH)3+OH-=AlO2-+2H2O
.(3)②、③、④、⑤元素形成的氢化物中,热稳定性最强的是
HF
HF
(填化学式),沸点最高的是H2O
H2O
(填化学式).(4)⑧、⑨元素的最高价氧化物的水化物酸性强弱比较
HClO4>H2SO4
HClO4>H2SO4
(填化学式).(5)元素⑩在周期表中的位置
第4周期ⅣA族
第4周期ⅣA族
;该元素的单质主要用途半导体材料
半导体材料
(选填一种).分析:(1)根据在元素周期表中的位置判断元素,利用原子的最外层电子数来分析电子式和结构式;
(2)根据Al(OH)3的两性和NaOH的碱性去书写反应的离子方程式;
(3)根据元素非金属性的递变规律判断;
(4)根据元素最高价氧化物的水化物酸性递变规律思考;
(5)根据元素周期表的结构和元素的性质与用途分析.
(2)根据Al(OH)3的两性和NaOH的碱性去书写反应的离子方程式;
(3)根据元素非金属性的递变规律判断;
(4)根据元素最高价氧化物的水化物酸性递变规律思考;
(5)根据元素周期表的结构和元素的性质与用途分析.
解答:解:(1)表中③是N,N2的电子式是 ;②是C,其最高氧化物是CO2,其结构式为O=C=O,故答案为:
;②是C,其最高氧化物是CO2,其结构式为O=C=O,故答案为: ;O=C=O;
;O=C=O;
(2)⑥、⑦分别是Na、Al,其最高价氧化物的水化物分别是NaOH和Al(OH)3,二者反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(3)②、③、④、⑤分别是C、N、O、F,根据同周期从左到右元素氢化物稳定性逐渐增强可知,稳定性最强的是HF,沸点最高的应该是H2O,因为在这几种元素的氢化物中只有H2O在常温下是液体,其余是气体(也可从氢键解释),故答案为:HF;H2O;
(4)⑧、⑨分别是S、Cl,根据同周期最高价氧化物的水化物从左到右酸性逐渐增强可知,酸性为:HClO4>H2SO4,故答案为:HClO4>H2SO4;
(5)⑩是Ge,处于周期表中的第4周期ⅣA族,与Si一样可做半导体材料,故答案为:第4周期ⅣA族;半导体材料.
 ;②是C,其最高氧化物是CO2,其结构式为O=C=O,故答案为:
;②是C,其最高氧化物是CO2,其结构式为O=C=O,故答案为: ;O=C=O;
;O=C=O;(2)⑥、⑦分别是Na、Al,其最高价氧化物的水化物分别是NaOH和Al(OH)3,二者反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(3)②、③、④、⑤分别是C、N、O、F,根据同周期从左到右元素氢化物稳定性逐渐增强可知,稳定性最强的是HF,沸点最高的应该是H2O,因为在这几种元素的氢化物中只有H2O在常温下是液体,其余是气体(也可从氢键解释),故答案为:HF;H2O;
(4)⑧、⑨分别是S、Cl,根据同周期最高价氧化物的水化物从左到右酸性逐渐增强可知,酸性为:HClO4>H2SO4,故答案为:HClO4>H2SO4;
(5)⑩是Ge,处于周期表中的第4周期ⅣA族,与Si一样可做半导体材料,故答案为:第4周期ⅣA族;半导体材料.
点评:本题考查的知识比较基础,具有一定的综合性和灵活性,要求学生掌握牢固的知识,并能理解和运用.

练习册系列答案
相关题目







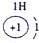
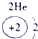
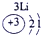
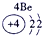
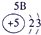
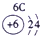
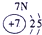
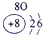
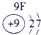
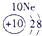
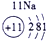





 表示的是
表示的是