题目内容
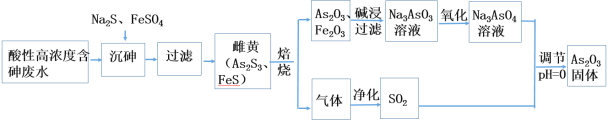
【题目】某工厂废金属屑中主要成分为Cu、Fe和Al(含有少量Al2O3和Fe2O3),某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
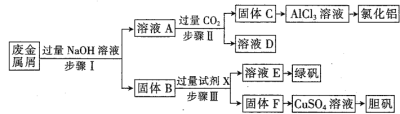
请回答:
(1)胆矾的化学式为___________________。
(2)溶液E为绿色溶液,则试剂X是______________。
(3)步骤I,首先加入温热NaOH溶液,作用是_________;-段时间后,再分批加入常温NaOH溶液,原因是___________。
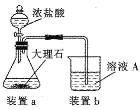
(4)在步骤II时,用如图装置制取CO2并通入溶液A中。-段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,可在a和b间加-个盛有饱和_________溶液的洗气瓶。
(5)保存FeSO4溶液时,需要滴加少量硫酸溶液,再加入适量_______(填化学式),防止变质。
【答案】CuSO4·5H2O 稀H2SO4 加快反应速率 由于反应放热,分批加入常温NaOH溶液,可以适当降低温度,防止反应过快,发生安全事故 NaHCO3 Fe
【解析】
Fe、Cu、Fe2O3都不与NaOH溶液反应,Al和Al2O3可与NaOH溶液反应,用含有Al、Fe、Cu和Al2O3和Fe2O3的废金属屑制取AlCl3、绿矾晶体(FeSO47H2O)和胆矾晶体流程为:合金中Al、Al2O3与NaOH反应,所得滤液A为NaAlO2溶液,经途径Ⅱ与足量二氧化碳发生AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,反应可生成Al(OH)3固体C,生成的Al(OH)3再和盐酸反应生成AlCl3,得到的AlCl3较纯净;溶液D为NaHCO3溶液;滤渣B为Fe、Cu和Fe2O3的混合物,加入足量X,得到的滤液E可以得到绿矾(FeSO4·7H2O),说明溶液E为FeSO4,则X为稀H2SO4;固体F为Cu,可用于制备胆矾,据此分析解答。
(1)胆矾是五水合硫酸铜,化学式为CuSO4·5H2O,故答案为:CuSO4·5H2O;
(2)根据上述分析,溶液E为绿色溶液,为FeSO4,试剂X为稀H2SO4,故答案为:稀H2SO4;
(3)步骤I是溶解铝和氧化铝,首先加入温热NaOH溶液,可以加快反应速率;由于反应放热,分批加入常温NaOH溶液,可以适当降低温度,防止反应过快,发生安全事故,故答案为:加快反应速率;由于反应放热,分批加入常温NaOH溶液,可以适当降低温度,防止反应过快,发生安全事故;
(4)用浓盐酸与大理石制取的二氧化碳中会混有氯化氢气体,为了防止氯化氢气体对实验的影响,需要除去。二氧化碳在饱和NaHCO3中不溶,氯化氢和NaHCO3反应生成二氧化碳气体,可以在a和b间加-个盛有饱和碳酸氢钠溶液的洗气瓶,除去二氧化碳中的氯化氢,故答案为:NaHCO3;
(5)硫酸亚铁容易被空气中的氧气氧化而变质,且硫酸亚铁能够水解,因此保存FeSO4溶液时,需要滴加少量硫酸溶液,抑制其水解,再加入适量铁粉,防止其被氧化,故答案为:Fe。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案