题目内容
【题目】氧化镁在易燃材料中常被用作阻燃剂,碳酸镁高温分解法是工业上制备轻质氧化镁的常用方法。镁硅矿主要成分为Mg3(Si2O5)(OH)4和还有少量的Fe2O3、Al2O3等。以镁硅矿为原料制备碳酸镁晶体(MgCO3nH2O)的生产流程如下:
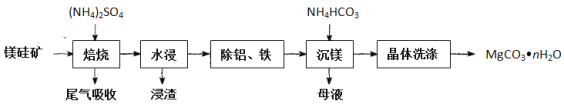
已知“焙烧”过程中的主要反应为:Mg3(Si2O5)(OH)4+5(NH4)2SO4![]() 3MgSO4+10NH3↑+2SiO2+7H2O↑+2SO3↑
3MgSO4+10NH3↑+2SiO2+7H2O↑+2SO3↑
(1)Mg3(Si2O5)(OH)4用氧化物的形式表示为___,焙烧产物NH3的电子式为__。
(2)为提高水浸速率,可采取的措施为__(任写一种)。“浸渣”的主要成分为__。
(3)“除铝、铁”时,需将溶液pH调至8.0左右,适宜作调节剂的是__(填字母代号)。
a.Ca(OH)2 b.Mg(OH)2 c.NH3H2O
(4)“沉镁”过程中反应的离子方程式为__。“沉镁”时若温度超过60℃,将会产生较多的碱式碳酸镁杂质,原因是___。
(5)流程中可以循环利用的物质是___(填化学式)。
(6)为测定产品MgCO3nH2O中的n值,称取15.6g产品进行充分加热至恒重,冷却,称得固体质量为4g,则n=__。
【答案】3MgO2SiO22H2O ![]() 将焙烧渣粉碎、加热或搅拌 SiO2 bc Mg2++2HCO3-+(n-1)H2O=MgCO3·nH2O↓+CO2↑ 升温促进Mg2+水解 (NH4)2SO4 3
将焙烧渣粉碎、加热或搅拌 SiO2 bc Mg2++2HCO3-+(n-1)H2O=MgCO3·nH2O↓+CO2↑ 升温促进Mg2+水解 (NH4)2SO4 3
【解析】
以石棉尾矿(主要含有Mg3(Si2O5)(OH)4和少量的Fe2O3、Al2O3)为原料制备碳酸镁晶体(MgCO3nH2O)的工艺流程:加入硫酸铵焙烧得到MgSO4、SiO2、Fe2O3、Al2O3,水浸,形成Mg2+、Fe3+、Al3+的溶液,SiO2不溶于水形成浸渣,加入Mg(OH)2或NH3H2O将pH调至8.0左右,将Fe3+、Al3+以氢氧化物的形式过滤除去,向含有镁离子的滤液中加入碳酸氢铵发生反应:Mg2++2HCO3-+(n-1)H2O=MgCO3nH2O↓+CO2↑,洗涤晶体可得,据此分析解答。
(1)化学式改写成相应的氧化物的形式,按照活泼金属氧化物、较活泼金属氧化物、SiO2、H2O的顺序来书写,Mg3(Si2O5)(OH)4用氧化物的形式表示为:3MgO2SiO22H2O;氨气为共价化合物,其电子式为:![]() ;故答案为:3MgO2SiO22H2O;
;故答案为:3MgO2SiO22H2O;![]() ;
;
(2)为提高水浸速率,可采取的措施有:将焙烧渣粉碎、加热或搅拌等;石棉尾矿加入硫酸铵焙烧得到MgSO4、SiO2、Fe2O3、Al2O3,水浸,SiO2不溶于水形成浸渣;故答案为:将焙烧渣粉碎、加热或搅拌;SiO2;
(3)“除铁、铝”时,需将pH调至8.0左右,选择不引入新杂质的试剂,故可选用Mg(OH)2或NH3H2O;故答案为:bc;
(4)“沉镁”过程中反应的离子方程式为:Mg2++2HCO3-+(n-1)H2O=MgCO3nH2O↓+CO2↑;升温促进Mg2+水解生成Mg(OH)2,Mg(OH)2与CO2反应生成碱式碳酸镁,故答案为:Mg2++2HCO3-+(n-1)H2O=MgCO3·nH2O↓+CO2↑;升温促进Mg2+水解;
(5)沉镁过程的滤液为(NH4)2SO4,可循环使用;故答案为:(NH4)2SO4;
(6)称取13.8gMgCO3nH2O进行受热分解,MgCO2nH2O受热分解生成MgO、CO2、H2O,最终剩余的固体为MgO4.0g,n(Mg)=![]() =0.1mol,则n(MgCO3)=n(Mg)=0.1mol,m(MgCO3)=8.4g,m(H2O)=13.8g-8.4g=5.4g,n(H2O)=
=0.1mol,则n(MgCO3)=n(Mg)=0.1mol,m(MgCO3)=8.4g,m(H2O)=13.8g-8.4g=5.4g,n(H2O)=![]() =0.3mol,1:n=n(MgCO3):n(H2O)=0.1:0.3,故n=3。
=0.3mol,1:n=n(MgCO3):n(H2O)=0.1:0.3,故n=3。

【题目】X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大。其相关信息如下表所示:
X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同 |
Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 |
Z元素的族序数是其周期数的三倍 |
W原子的第一至第六电离能分别为:I1=578KJ·mol-1I2=1817KJ·mol-1I3=2745KJ·mol-1 I4=11575KJ·mol-1I5=14830KJ·mol-1I6=18376KJ·mol-1 |
Q为前四周期中电负性最小的元素 |
元素R位于周期表的第10列 |
回答下列问题:
(1)Y元素的基态原子中未成对电子数为______;X、Y、Z三种元素原子的第一电离能由小到大的顺序为____________(用元素符号表示)。
(2)W的氯化物的熔点比Q的氯化物的熔点__________(填“高”或“低”),理由是__________________________________________________。
(3)光谱证实元素W的单质与强碱性溶液反应有[W(OH)4]-生成,则[W(OH)4]-中存在(填字母)_____________。
a.极性共价键 b.非极性共价键 c.配位键 d.氢键
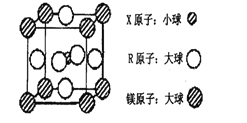
(4)含有X、R和镁三种元素的某种晶体具有超导性,其结构如下图所示。则该晶体的化学式为_______;晶体中每个镁原子周围距离最近的R原子有_______个。