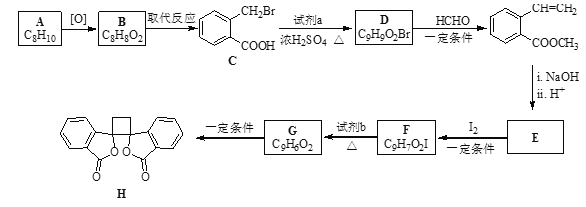
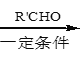
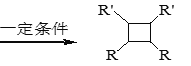
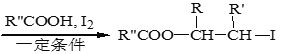题目内容
【题目】X、Y、Z、W均为短周期主族元素,X、Y、Z原子的最外层电子数之和为10。X与Z同族,Y最外层电子数等于X次外层电子数,且Y原子半径大于Z。W的最外层电子数等于X的核外电子总数,且W单质常温下为固体。请回答下列问题:
(1)Z在周期表中的位置为______________。
(2)Y元素形成的离子的结构示意图为____________。
(3)X、Y、Z三种元素对应的原子半径大小关系为____________(填元素符号)。
(4)X和Z形成的简单氢化物,热稳定性较好的是______________(填化学式)。
(5)Y与X的最高价氧化物在一定条件下反应的实验现象是___________________________。
(6)下列说法正确的是_______。
A.W的氧化物,均满足8e—稳定结构
B.最高价氧化物对应的水化物的酸性W>Z
C.由于Z的氧化物ZO2既可与酸反应,又能与碱反应,所以ZO2为两性氧化物
D.W的氧化物WO2,具有还原性,能使酸性KMnO4溶液褪色
(7)足量的单质Y与一定量的W的最高价氧化物对应的水化物的浓溶液,在一定条件下充分反应,所得气体的成分为_________________。
【答案】第三周期ⅣA族 ![]() Mg>Si>C CH4 剧烈燃烧,放出大量热,产生耀眼的白光,生成白色固体和黑色粉末 BD SO2和H2
Mg>Si>C CH4 剧烈燃烧,放出大量热,产生耀眼的白光,生成白色固体和黑色粉末 BD SO2和H2
【解析】
X、Y、Z、W均为短周期主族元素,Y最外层电子数等于X次外层电子数,则Y最外层电子数为2,X与Z同族,X、Y、Z原子的最外层电子数之和为10,则X、Z最外层电子数为![]() =4,则X为C元素,Z为Si元素;Y原子半径大于Z,则Y为Mg元素;W的最外层电子数等于X的核外电子总数,且W单质常温下为固体,则W为S元素,据此解答。
=4,则X为C元素,Z为Si元素;Y原子半径大于Z,则Y为Mg元素;W的最外层电子数等于X的核外电子总数,且W单质常温下为固体,则W为S元素,据此解答。
根据分析可知,X为C,Y为Mg,Z为Si元素,W为S元素;
(1)Si的原子序数为14,位于元素周期表中第三周期ⅣA族;
(2)Y元素形成的离子为镁离子,镁离子的核电荷数为12,核外电子总数为10,其离子结构示意图为![]() ;
;
(3)同一周期从左向右原子半径逐渐减小,电子层越多原子半径越大,则原子半径大小为:Mg>Si>C;
(4)非金属性:C>Si,则简单氢化物的热稳定性较好的是CH4;
(5)X的最高价氧化物为二氧化碳,Mg在二氧化碳中剧烈燃烧,放出大量热,产生耀眼的白光,生成白色固体和黑色粉末;
(6)A.W的氧化物有二氧化硫和三氧化硫,二氧化硫中S、O原子满足8e﹣稳定结构,而三氧化硫中S原子最外层电子数为6+3=9,不满足8电子稳定结构,故A错误;
B.非金属性S>Si,则最高价氧化物对应的水化物的酸性:W>Z,故B正确;
C.由于Z的氧化物SiO2不与硫酸、盐酸、硝酸等强酸反应,能够与强碱反应,属于酸性氧化物,故C错误;
D.W的氧化物SO2具有还原性,能够被酸性高锰酸钾氧化,从而使酸性KMnO4溶液褪色,故D正确;
故答案为:BD;
(7)W的最高价氧化物对应的水化物的浓溶液为浓硫酸,足量的单质Mg浓硫酸在一定条件下充分反应,Mg与浓硫酸生成二氧化硫气体,与稀硫酸反应生成氢气,所得气体的成分为SO2和H2。

 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案【题目】四氢铝锂(LiAlH4)常作有机合成的重要还原剂。以辉锂矿(主要成分是Li2O·Al2O3·4SiO2,含少量Fe2O3)为原料合成四氢铝锂的流程如下:
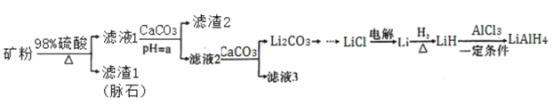
已知:①几种金属氢氧化物沉淀的pH如表所示:
物质 | Fe(OH)3 | Al(OH)3 |
开始沉淀的pH | 2.3 | 4.0 |
完全沉淀的pH | 3.7 | 6.5 |
②常温下,Ksp(Li2CO3)=2.0×10-3,Li2CO3在水中溶解度随着温度升高而减小。
回答下列问题:
(1)上述流程中,提高“酸浸”速率的措施有________________、加热;加入CaCO3的作用是_____,“a”的最小值为______________。
(2)写出LiH和AlC13反应的化学方程式为_____________(条件不作要求)。
(3)用热水洗涤Li2CO3固体,而不用冷水洗涤,其目的是_______________。
(4)四氢铝锂LiAlH4溶解于NaOH溶液后得到无色透明溶液,并产生一种无色气体。请写出该反应的离子方程式_____________________。
(5)在有机合成中,还原剂的还原能力通常用“有效氢”表示,其含义是1克还原剂相当于多少克氢气的还原能力。LiAlH4的“有效氢”为________________(结果保留2位小数)。