题目内容
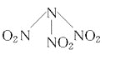
【题目】在一定温度下,向2 L恒容密闭容器中充入1 mol A,发生A(g)![]() B(g) + C(g)反应。反应过程中c(C) 随时间变化的曲线如下图所示,下列说法不正确的是
B(g) + C(g)反应。反应过程中c(C) 随时间变化的曲线如下图所示,下列说法不正确的是

A.反应在0 ~50 s的平均速率v(C) =1.6×10-3mol/(L·s)
B.该温度下,反应的平衡常数K = 0.025
C.保持其他条件不变,升高温度,平衡时c(B)=0.11mol/L,则该反应的ΔH<0
D.反应达平衡后,再向容器中充入1 mol A,该温度下再达到平衡时,0.1 mol/L<c(C)<0.2 mol/L
【答案】C
【解析】
A、在前50秒,C的浓度变化量为0.08mol/L,所以反应速率=0.08/50=1.6×10-3mol/(L·s),正确,不选A;
B、在250秒到平衡,C的浓度为0.10mol/L,根据方程式计算,平衡时A的浓度为0.4 mol/L,B的浓度为0.1 mol/L,则平衡常数=0.1×0.1/0.4=0.025,正确,不选B;
C、保持其他条件不变,升温,平衡时B的浓度比原来多,则说明平衡正向移动,即正反应为吸热反应,错误,选C;
D、再充入1 molA,相当于加压到原来的2倍压强,平衡逆向移动,C的浓度比原来的浓度大,但小于原来的2倍,正确,不选D;
答案选C。

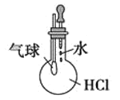
【题目】(11分)某课外小组设计的实验室制取乙酸乙酯的装置如图14-2所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
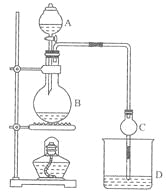
已知①无水氯化钙可与乙醇形成难溶于水的CaCl2·6 C2H50H ②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
请回答:
(1)浓硫酸的作用是 ;若用同位素180示踪法确定反应产物水分子中氧原子的提供者,写出能表示180位置的化学方程式: 。
(2)球形干燥管C的作用是 。若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示) ;反应结束后D中的现象是 .
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出 (填物质名称);再加入(此空从下列选项中选择,填编号) ,然后进行蒸馏,收集77℃左右的馏分,以得较纯净的乙酸乙酯。
A.五氧化二磷 | B.碱石灰 | C.无水硫酸钠 | D.生石灰 |