题目内容
【题目】用双线桥法标出电子转移的方向和数目
①Cl2+SO2 +2H2O=H2SO4 +2HCl ____________________
②2Na2O2+2H2O=4NaOH+O2↑____________________
【答案】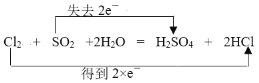

【解析】
①Cl2+SO2 +2H2O=H2SO4 +2HCl,Cl2中的Cl化合价降低,SO2中的S化合价升高。
②2Na2O2+2H2O=4NaOH+O2↑,Na2O2中的O既升高又降低。
①Cl2+SO2 +2H2O=H2SO4 +2HCl中Cl化合价降低,由0价降低到1价,得到1个电子,2个Cl降低得到2个电子,S化合价升高,由+4价变为+6价,因此用双线桥表示电子转移的方法为 ;故答案为:
;故答案为: 。
。
②2Na2O2+2H2O=4NaOH+O2↑,Na2O2中的O既升高又降低,由1价升高到0价,失去1个电子,得到一个氧气,转移2×e-,由1价降低到2价,得到1个电子,有2个1价O降低,因此转移2×e-,因此用双线桥表示电子转移的方法为 ;故答案为:
;故答案为: 。
。

【题目】实验室有一未知浓度的盐酸,某同学在实验室中进行实验测定盐酸的浓度。请完成下列填空:
配制100mL0.10molL-1NaOH标准溶液。需用托盘天平称量___g的氢氧化钠固体。
取20.00mL待测盐酸放入锥形瓶中,并滴加 2~3滴酚酞作指示剂,用配制的标准 NaOH溶液进行滴定。重复上述滴定操作 2~3次,记录数据如下:
滴定次数 | 待测盐酸的体积/mL | 0.10 mol/L NaOH 溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
第一次 | 20.00 | 2.00 | 28.15 |
第二次 | 20.00 | 1.50 | 29.50 |
第三次 | 20.00 | 0.20 | 26.55 |
①该实验滴定达到终点的标志是_________
②根据上述数据,可计算出该盐酸的浓度约为______。(保留两位有效数字)
③在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______。(双选)
A 滴定终点读数时俯视读数 B 酸式滴定管使用前,水洗后未用待测盐酸润洗
C 锥形瓶水洗后未干燥 D 碱式滴定管尖嘴部分有气泡,滴定后消失
E 称量NaOH 固体时,混入少量KOH杂质
④现用以上实验配制的0.10molL-1NaOH溶液滴定未知浓度的CHCOOH溶液,反应恰好完全时,下列叙述中正确的是_____
A 溶液呈中性,可选用甲基橙或酚酞作指示剂
B 溶液呈中性,只能选用石蕊作指示剂
C 溶液呈碱性,可选用甲基橙或酚酞作指示剂
D 溶液呈碱性,只能选用酚酞作指示剂