��Ŀ����
����Ŀ��������Ԫ��A��B��X��Y��Zԭ��������������AԪ��������������������������ԭ����������ȣ�B����̬�⻯������Ȼ������Ҫ�ɷ֣�Y�����������������ڲ��������3�� ��Z���ʿ��Ƴɰ뵼����ϣ�B��Zͬ���塣
��д��Z��ԭ�ӽṹʾ��ͼ_______________________��
��Ԫ��Y�����ڱ��е�λ��________________________��
��A��X���γɵ�������Ϊ10�����������γɵķ��ӵĽṹʽΪ_______________���γɵ����ӵĻ�ѧʽΪ_________________��
���ϻ�����BY2��ZY2���۵�ߵͣ�___________��___________���ѧʽ������ΪZY2����________���壨������ͣ����ۻ�ʱ���ƻ�___________���������ۼ����������Ӽ����������Ӽ�������������
���𰸡�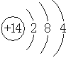 �ڶ����� ��A��
�ڶ����� ��A�� ![]() NH4+ SiO2 CO2 ԭ�� ���ۼ�
NH4+ SiO2 CO2 ԭ�� ���ۼ�
��������
������Ԫ��A��B��X��Y��Zԭ��������������AԪ��������������������������ԭ����������ȣ���A��HԪ�أ�B����̬�⻯������Ȼ������Ҫ�ɷ֣���B��CԪ�أ�Y�����������������ڲ��������3��������������С��8������Y��OԪ�أ�X��ԭ����������B��С��Y������X��NԪ�أ�Z���ʿ��Ƴɰ뵼����ϣ�B��Zͬ���壬��Z��SiԪ�أ��ٽ�����ʽṹ�����ʽ��
��Z��SiԪ�أ���ԭ�Ӻ�����3�����Ӳ㡢������������4��������ԭ�ӽṹʾ��ͼΪ��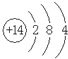 ��
��
��Y��O��Oԭ�Ӻ�����2�����Ӳ㡢������������6������OԪ��λ�ڵڶ����ڢ�A�壻
��A��X���γɵ�������Ϊ10������NH3��Nԭ�Ӻ�ÿ��Hԭ��֮�����һ�����ۼ�����ṹʽΪ![]() ���γɵ�笠����ӻ�ѧʽΪNH4+��
���γɵ�笠����ӻ�ѧʽΪNH4+��
��Z��SiԪ�أ�B��CԪ�أ�Y��OԪ�أ�BY2ΪCO2��ZY2ΪSiO2��������������ԭ�Ӿ��塢������̼�������ڷ��Ӿ��壬ԭ�Ӿ����۵�ߣ����Ӿ�����۵�ͣ���CO2���۵����SiO2�����Ӿ����ۻ�ʱ�ƻ����Ӽ���������ԭ�Ӿ����ۻ�ʱ��Ҫ�ƻ����ۼ���