��Ŀ����
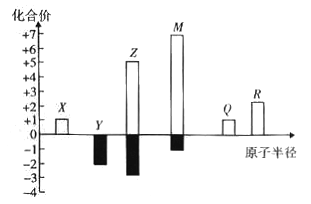
����Ŀ��A��B��C��D�ǰ�ԭ��������С�������еĵڶ���������Ԫ�صĵ��ʡ�B��E��Ϊ��ɿ����ijɷ֡�������F����ɫ��Ӧ�ʻ�ɫ����G�У��ǽ���Ԫ�������Ԫ�ص�ԭ�Ӹ�����Ϊ1��2����һ�������£�������֮����ת����ϵ����ͼ(ͼ�в��ֲ���δ�г�)��
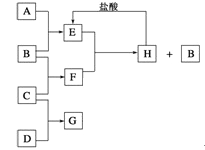
����д���пհף�
��1��A��C�ֱ���_______________��
��2��H�����ᷴӦ����E�Ļ�ѧ����ʽ��_____________________________________________��
��3��E��F��Ӧ�Ļ�ѧ����ʽ��_____________________________________________________��
��4��F��ˮ��Ӧ�����ӷ���ʽ��____________________________________________________��
��5������E�ĽṹʽΪ��_____________������A-H���������ӻ������ǣ�_____________��
���𰸡� ̼���� Na2CO3 + 2HCl��2NaCl + H2O + CO2�� 2Na2O2 + 2CO2��2Na2CO3 + O2 2Na2O2 + 2H2O��4Na+ +4OH- + O2�� O=C=O Na2O2 ��Na2S ��Na2CO3
��������A��B��C��D�ǰ�ԭ��������С�������еĵڶ���������Ԫ�صĵ��ʣ�B��E��Ϊ��ɿ����ijɷ֣�����B��C��Ӧ�õ�F��F����ɫ��Ӧ�ʻ�ɫ��˵��F���ƵĻ������CΪNa������BΪO2��E��CO2����FΪNa2O2��H��Na2CO3��AΪ̼��G�ǵ���C��D���϶��ɣ�ԭ�Ӹ�����ΪD��C=1��2����G��DԪ��Ϊ-2�ۣ���ԭ������D��C����DΪ��GΪNa2S����
��1�������Ϸ�����֪��AΪ̼��CΪ�����ƣ���2��H��Na2CO3�������ᷴӦ���ɶ�����̼��ˮ����Ӧ�ķ���ʽΪNa2CO3+2HCl��2NaCl+H2O+CO2������3��E��F��ӦΪCO2��Na2O2�ķ�Ӧ������̼���ƺ���������Ӧ�Ļ�ѧ����ʽΪ2CO2+2Na2O2��2Na2CO3+O2����4������������ˮ��Ӧ����������������������ʽΪ2Na2O2+2H2O��4Na++4OH- +O2������5��������̼�Ľṹ��ʽΪO=C=O���������Ӽ��Ļ����������ӻ�������������ӻ��������Na2O2 ��Na2S ��Na2CO3��