题目内容
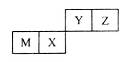
已知A、B、C、D、E是短周期中原子序数依次增大的5种元素,A在反应中既不容易得电子也不容易失电子,元素B的最外层电子数是电子层数的3倍,元素D与A为同族元素,元素C和E形成的化合物CE是海水中的主要成分。下列说法不正确的是
A.离子半径:r(E)>r(B)>r(C)
B.熔点:CE>DE4
C.C与B形成的两种化合物中化学键类型不同
D.A、D、E的最高价氧化物对应水化物的酸性逐渐增强
A.离子半径:r(E)>r(B)>r(C)
B.熔点:CE>DE4
C.C与B形成的两种化合物中化学键类型不同
D.A、D、E的最高价氧化物对应水化物的酸性逐渐增强
D
试题分析: A在反应中既不容易得电子也不容易失电子,因此A是第ⅣA族元素,元素D与A为同族元素,所以根据原子序数A小于D可知,A应该是碳元素,则D是硅元素。元素B的最外层电子数是电子层数的3倍,原子序数大于碳元素而小于硅元素,则B是氧元素。元素C和E形成的化合物CE是海水中的主要成分,因此C是钠元素,E是氯元素。A、离子的核外电子层数越多,离子半径越大。核外电子排布相同的微粒离子半径随原子序数的增大而减小,因此离子半径:r(E)>r(B)>r(C),A正确;B、氯化钠形成的晶体是离子晶体,四氯化硅形成的晶体是分子晶体,因此熔点CE>DE4,B正确;C、C与B形成的两种化合物是氧化钠和过氧化钠,前者含有离子键,后者含有离子键和非极性键,中化学键类型不同,C正确;D、非金属性越强,最高价氧化物对应水化物的酸性逐渐增强,非金属是Cl>C>Si,所以D、A、E的最高价氧化物对应水化物的酸性逐渐增强,D不正确,答案选D。

练习册系列答案
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案
相关题目


 。判断HF
。判断HF