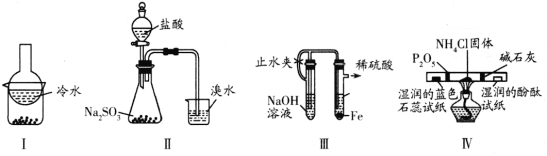
题目内容
【题目】单质硫在NaOH的热浓溶液中发生歧化反应,将2.56g硫与含0.0600molNaOH的热溶液反应恰好生成amolNa2Sx和bmolNa2S2O3,再加入1.00mol/L的NaClO溶液VmL,使溶液中所有硫元素全部转化为Na2SO4。计算:(1)a/b=________;
(2)V至少为___________。
【答案】![]()
![]()
【解析】
(1)通过S单质的物质的量计算出S和NaOH的物质的量之比,确定a与b的比值;
(2)根据得失电子守恒、原子守恒进行计算。
(1)2.56g硫与含0.0600molNaOH的热溶液反应恰好生成amolNa2Sx和bmolNa2S2O3,根据条件硫单质的物质的量为![]() =0.08mol,硫单质和氢氧化钠的物质的量之比为4:3,反应为
=0.08mol,硫单质和氢氧化钠的物质的量之比为4:3,反应为![]() ,所以a=0.02mol,b=0.01mol,因此a/b=2;
,所以a=0.02mol,b=0.01mol,因此a/b=2;
(2)加入1.00mol/L的NaClO溶液VmL,使溶液中所有硫元素全部转化为Na2SO4,硫元素守恒,所以可以看做硫单质全部变成了+6价,转移电子物质的量为0.48mol,次氯酸钠得电子,氯元素从+1价变为-1价,所以次氯酸钠的物质的量为0.24mol,所以V=240mL。

【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
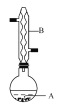
![]() +
+![]()
![]()
![]() +H2O
+H2O
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 水中溶解性 | |
异戊醇 | 88 | 0.812 3 | 131 | 微溶 |
乙酸 | 60 | 1.049 2 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.867 0 | 142 | 难溶 |
实验步骤:
在A中加入4.4 g异戊醇、6.0 g乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50 min,反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液 和水 洗涤,分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9 g。回答下列问题:
(1)仪器B的名称是________,它的作用是____________________。
(2)在洗涤操作中,第一次水洗的主要目是___________________________
第二次水洗的主要目的是_______________________________________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后____(填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是_____________________________。
(5)实验中加入少量无水MgSO4的目的是___________________________。
(6)在蒸馏操作中,仪器选择及安装都正确的是____(填标号)。
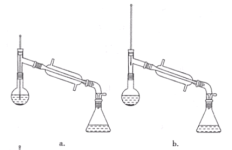
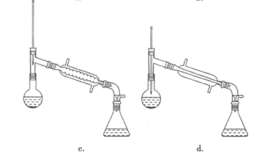
(7)本实验的产率是____(填标号)。
a.30% b.40% c. 60% d.90%
(8)在进行蒸馏操作时,若从130℃便开始收集馏分,会使实验的产率偏____(填“高”或“低”),其原因是____________________________________。