��Ŀ����
����Ŀ��ʵ��С���Ʊ��������(K2FeO4)��̽�������ʡ�
���ϣ�K2FeO4Ϊ��ɫ���壬����KOH��Һ������ǿ�����ԣ������Ի�������Һ�п��ٲ���O2���ڼ�����Һ�н��ȶ���
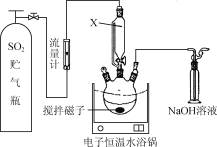
�� �Ʊ�K2FeO4(�г�װ����)
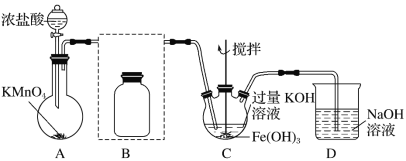
��1��A������_____________
��2���ڴ���ֽ�Ͻ�����װ��B�������������������Լ���________
��3����C�еõ���ɫ����Ļ�ѧ����ʽΪ��______________
��̽��K2FeO4�����ʣ�ȡC����ɫ��Һ������ϡ���ᣬ�����������Һa��Ϊ֤���Ƿ�K2FeO4������Cl��������Cl2��������·�����
������ | ȡ����a���μ�KSCN��Һ����������Һ�ʺ�ɫ |
������ | ��KOH��Һ���ϴ��C�����ù��壬����KOH��Һ��K2FeO4�ܽ⣬�õ���ɫ��Һb��ȡ����b���μ����ᣬ��Cl2���� |
��4���ɷ���������Һ����֪a�к���_____���ӣ��������ӵIJ��������ж�һ����K2FeO4��Cl����������������_______����(�����ӷ���ʽ��ʾ)��
��5�����ݷ�����ó���������Cl2________FeO42- (����>������<��)����K2FeO4���Ʊ�ʵ��ʵ�������Cl2��FeO42-��������ǿ����ϵ�෴��ԭ����______��
���𰸡���������װ��  3Cl2��2Fe(OH)3��10KOH===2K2FeO4��6KCl��8H2O Fe3�� 4FeO42-��20H��==4Fe3����3O2����10H2O < ��Һ����Բ�ͬ
3Cl2��2Fe(OH)3��10KOH===2K2FeO4��6KCl��8H2O Fe3�� 4FeO42-��20H��==4Fe3����3O2����10H2O < ��Һ����Բ�ͬ
��������
��1��Ũ�����KMnO4��Ͽ�����������
��2��װ��BΪ����װ�ã���Ӧʹ��Ũ���ᣬŨ�����ӷ�����HCl��ʹ�ò�����Cl2�л���HCl����Ҫ��ȥHCl���ɽ��������ͨ������ʳ��ˮ�ﵽ���ӵ�Ŀ�ģ�
��3��C�еõ���ɫ�������Һ����ɫ��ΪK2FeO4���ڼ��������£�Cl2��������Fe��OH��3��ȡK2FeO4������غ㷨д��������Ӧ�Ļ�ѧ����ʽ��
��4������I�м���KSCN��Һ����������Һ�ʺ�ɫ��˵����Ӧ����Fe3+���������ӵIJ��������ж�һ��K2FeO4��Cl-������ע��K2FeO4�ڼ�����Һ���ȶ���������Һ�п��ٲ���O2������ת��ΪFe3+��
��5��Fe��OH��3�ڼ��������±�Cl2����ΪFeO42-������˵��Cl2�������Դ���FeO42-����������ʵ�������Cl2��FeO42-��������ǿ����ϵ�෴����������FeO42-����������������Cl-����Cl2��ע�����ַ�Ӧ��ϵ��������Խ��ʲ�һ����
��1��Ũ�����KMnO4��Ͽ�������������Aװ�õ���������������װ�ã�
��2��װ��BΪ����װ�ã���Ӧʹ��Ũ���ᣬŨ�����ӷ�����HCl��ʹ�ò�����Cl2�л���HCl����Ҫ��ȥHCl���ɽ��������ͨ������ʳ��ˮ�ﵽ���ӵ�Ŀ�ģ�����װ��BӦΪ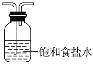 ��
��
��3��C�еõ���ɫ�������Һ����ɫ��ΪK2FeO4���ڼ��������£�Cl2��������Fe��OH��3��ȡK2FeO4��������Ӧ�Ļ�ѧ����ʽΪ3Cl2��2Fe(OH)3��10KOH===2K2FeO4��6KCl��8H2O��
��4������I�м���KSCN��Һ����������Һ�ʺ�ɫ��˵����Ӧ����Fe3+���������ӵIJ��������ж�һ��K2FeO4��Cl-������ע��K2FeO4�ڼ�����Һ���ȶ���������Һ�п��ٲ���O2������ת��ΪFe3+��������ӦΪ��4FeO42-+20H+�T4Fe3++3O2��+10H2O��
��5��Fe��OH��3�ڼ��������±�Cl2����ΪFeO42-������˵��Cl2�������Դ���FeO42-����������ʵ�������Cl2��FeO42-��������ǿ����ϵ�෴����������FeO42-����������������Cl-����Cl2�����ַ�Ӧ��ϵ��������Խ��ʲ�һ�������Կ���˵����Һ����Ի�Ӱ�����������Ե�ǿ����

 ���ɶ���ܲ��¿�ֱͨ�߿�ϵ�д�
���ɶ���ܲ��¿�ֱͨ�߿�ϵ�д�