题目内容
【题目】原电池的发明是化学对人类的一项重大贡献。
(1)一种新型燃料电池,它以多孔铂板为两个电极插入稀硫酸中,然后分别向两极通入氢气和氧气而获得电能。通入氢气的电极反应式为_________________。
(2)电子工业上常利用FeCl3溶液腐蚀铜板制作印刷电路,若将该反应原理设计成原电池,请写出原电池的正极反应______________________________。
(3)常温下,将除去表面氧化膜的铝片、铜片插入浓HNO3中组成原电池装置如图甲所示,测得原电池的电流强度(I)随时间(t)的变化如图乙所示,反应过程中有红棕色气体产生。

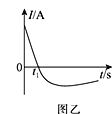
t1s前,原电池的负极是铝片,正极的电极反应式为________,溶液中的H+向______(填“正”或“负”)极移动。t1s后,外电路中电子流动方向发生改变,其原因是_________________。
【答案】 H2-2e-=2H+ Fe3++e-=Fe2+ 2H++NO3-+e-=NO2↑+H2O 正 Al在浓硝酸中钝化,形成的氧化膜阻止了Al的进一步反应,此时Cu变成了负极
【解析】(1)酸性条件下,氢气在负极失电子失去氢离子,据此解答;
(2)FeCl3溶液与Cu反应生成氯化亚铁和氯化铜;Cu失电子发生氧化反应作负极,铜发生氧化反应;不如Cu活泼的金属或导电的非金属作正极,氯化铁在正极上发生还原反应,据此解答;
(3)0-t1时,Al为负极,氧化得到氧化铝,Cu为正极,正极上硝酸根放电生成二氧化氮,随着反应进行铝表面钝化形成氧化膜阻碍反应进行,t1时,铜做负极反应,Al为正极,电子流动方向改变,据此解答。
(1)酸性条件下,氢气在负极失电子失去氢离子,则负极的电极方程式:H2-2e-=2H+;故答案为:H2-2e-=2H+;
(2)FeCl3溶液与Cu反应生成氯化亚铁和氯化铜,反应的化学方程式为:Cu+2FeCl3=CuCl2+2FeCl2,Cu失电子发生氧化反应作负极、不如Cu活泼的金属或导电的非金属作正极,氯化铁在正极上发生还原反应,电极反应式为Fe3++e-=Fe2+,故答案为:Fe3++e-=Fe2+;
(3)0-t1时,Al为负极,氧化得到氧化铝,Cu为正极,正极上硝酸根放电生成二氧化氮,正极电极反应式为:2H++NO3-+e-=NO2↑+H2O,溶液中阳离子向正极移动,即溶液中的H+向正极移动;随着反应进行,Al在浓硝酸中钝化,形成的氧化膜阻止了Al的进一步反应,此时Cu变成了负极,Al为正极,因此外电路中电子流动方向发生改变,故答案为:2H++NO3-+e-=NO2↑+H2O;正;Al在浓硝酸中钝化,形成的氧化膜阻止了Al的进一步反应,此时Cu变成了负极。

【题目】50mL 0.55molL﹣1盐酸与50mL 0.50molL﹣1NaOH溶液在如图的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 .
(2)从装置图上看除了缺少一种玻璃仪器外,还有一处不妥的是: .
(3)若实验中改用50mL 0.55molL﹣1醋酸溶液进行反应,与上述实验相比,所放出的热量(填“减少”“不变”“增多”);
(4)若实验改用25mL 0.55molL﹣1硫酸与25mL 0.50molL﹣1Ba(OH)2溶液代替上述反应,所求得的中和热△H (填“偏大”“偏小”“无影响”).
(5)已知:Q=cm△t,如果盐酸和NaOH溶液的密度均为1gcm﹣3 , 反应后混合溶液的比热容c=4.18J(g℃)﹣1 . 实验数据如表:根据上表中所测数据,通过计算得到中和热△H=kJ/mol(保留一位小数).
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
① | 20.3 | 20.3 | 23.6 |
② | 20.3 | 20.3 | 23.7 |
③ | 20.3 | 20.3 | 25.9 |
④ | 20.3 | 20.3 | 23.8 |
(6)下列操作能引起△H偏大的是:(填序号)操作.
①大烧杯上不盖硬纸板
②用环形铜丝搅拌棒搅拌反应混合溶液
③分多次把NaOH溶液倒入装盐酸的小烧杯中.


