题目内容
18.氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.请回答下列问题.(1)砷原子核外电子排布式为1s22s22p63s23p63d104s24p3.
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为配位键,该化学键能够形成的原因是CN-能提供孤对电子,Fe3+能接受孤对电子(或Fe3+有空轨道).
(3)已知:
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
①CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是结构相似时,相对分子质量越大,分子间作用力越大,因此CH4的沸点低于SiH4;但氨气分子间还存在氢键,则NH3的沸点高于PH3
②CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是C-H键的键能大于Si-H键的键能,N-H键的键能大于P-H键的键能,因此分解温度CH4的分解温度高于SiH4,NH3的分解温度高于PH3.
分析 (1)As的原子序数为33,根据能量最低原理书写电子排布式;
(2)当中心原子有空轨道,配离子含有孤对电子时,能形成配位键;
(3)①利用相对分子质量分析分子间作用力,并注意氨气分子中有氢键;
②非金属性越强,气态氢化物越稳定.
解答 解:(1)As的原子序数为33,基态原子的电子排布式为1s22s22p63s23p63d104s24p3,故答案为:1s22s22p63s23p63d104s24p3;
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的化学键类型为配位键,Fe3+有空轨道,能接受孤对电子,CN-能提供孤对电子,所以能形成配位键,
故答案为:配位键;CN-能提供孤对电子,Fe3+能接受孤对电子(或Fe3+有空轨道);
(3)①因结构相似时,相对分子质量越大,分子间作用力越大,因此CH4的沸点低于SiH4;但氨气分子间还存在氢键,则NH3的沸点高于PH3,
故答案为:结构相似时,相对分子质量越大,分子间作用力越大,因此CH4的沸点低于SiH4;但氨气分子间还存在氢键,则NH3的沸点高于PH3;
②因非金属性C>Si,N>P,则气态氢化物的稳定性CH4>SiH4,NH3>PH3;稳定性强的物质分解需要的温度高,从键能上可知,C-H键的键能大于Si-H键的键能,
N-H键的键能大于P-H键的键能,因此分解温度CH4的分解温度高于SiH4,NH3的分解温度高于PH3,
故答案为:C-H键的键能大于Si-H键的键能,N-H键的键能大于P-H键的键能,因此分解温度CH4的分解温度高于SiH4,NH3的分解温度高于PH3.
点评 本题考查物质的结构与性质,注重对电子排布式、沸点比较、稳定性的比较及应用的考查,考查点较多,难度较大.

练习册系列答案
相关题目
6.常温时的下列溶液,说法正确的是( )
| A. | 某物质的溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,则该溶液的pH一定为14-a | |
| B. | CH3COONa溶液与HCl溶液混合所得的中性溶液中:c(Na+)>c(Cl-) | |
| C. | Na2S和NaHS的混合溶液中:c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-) | |
| D. | pH=8的NaHCO3溶液中:c(HCO3-)>c(CO32-)>c(OH-) |
8.实验室利用以下反应制取少量氮气:NaNO2+NH4Cl═NaCl+N2↑+2H2O,关于该反应的下列说法正确的是( )
| A. | NaNO2发生氧化反应 | |
| B. | NH4Cl 中的氮元素被还原 | |
| C. | N2既是氧化产物,又是还原产物 | |
| D. | 每生成1mol N2转移电子的物质的量为6mol |

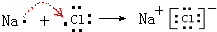 、
、 ;
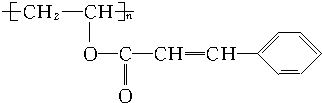
;
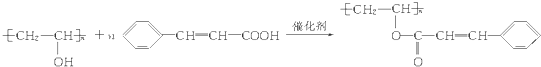 .
.