题目内容
“天宫一号”目标飞行器与“神舟九号”载人飞船的交会对接,标志着我国具备了建设空间站的基本能力。下列有关说法正确的是
| A.火箭升空的动力主要来源于化学能 |
| B.“神舟九号”飞船的太阳能帆板将太阳能直接转换为动能 |
| C.“天宫一号”中的氢氧燃料电池将电能转换为化学能 |
| D.“天宫一号”利用太阳能将水加热分解为氢气和氧气 |
A
解析试题分析:A、火箭升空的动力主要来源于推进剂之间的化学反应,属于化学能,正确;B、“神舟九号”飞船的太阳能帆板将太阳能直接转换为电能,错误;C、“天宫一号”中的氢氧燃料电池将化学能转换为电能,错误;D、“天宫一号”利用太阳能将水电解为氢气和氧气,错误。
考点:考查能量的转化形式。

练习册系列答案
相关题目
有关能量的判断或表示方法正确的是
| A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 |
| B.从C(石墨)==C(金刚石) ΔH=+1.19 kJ·mol-1,可知:金刚石比石墨更稳定 |
| C.由H+(aq)+OH-(aq)==H2O(l) ΔH=-57.3 kJ·mol-1,可知:含0.5 mol H2SO4的浓溶液与含1 molNaOH的溶液混合,放出热量大于57.3 kJ |
| D.2 g H2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l) ΔH=-285.8 kJ·mol-1 |
氢化热是指一定条件下,1 mol 不饱和化合物加氢时放出的热量。表中是环己烯( )、环己二烯(
)、环己二烯( )和苯的氢化热数据。
)和苯的氢化热数据。
| 化合物 | 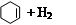  | 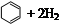  | 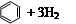  |
| 氢化热 (kJ/mol) | 119.7 | 232.7 | 208.4 |
根据表中数据推断正确的是
A.环己二烯与H2的反应最剧烈
B.环己烯、环己二烯和苯有相同的官能团
C.三种化合物中环己二烯的稳定性最强
D.上述条件下,1 mol
 转变为
转变为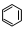 时放热
时放热 某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g) 2AB3(g)化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是
2AB3(g)化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是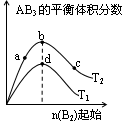
A.若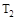 > >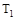 ,则正反应一定是放热反应 ,则正反应一定是放热反应 |
B.达到平衡时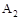 的转化率大小为:b>a>c 的转化率大小为:b>a>c |
C.若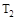 > >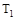 ,达到平衡时b、d点的反应速率为 ,达到平衡时b、d点的反应速率为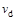 > >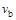 |
D.在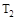 和 和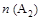 不变时达到平衡, 不变时达到平衡,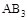 的物质的量大小为:c>b>a 的物质的量大小为:c>b>a |
下列各表述与示意图一致的是
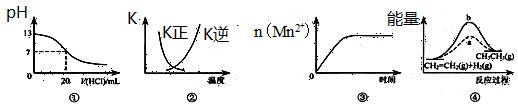
| A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化 |
B.图②中曲线表示反应2SO2(g) + O2(g)  2SO3(g);ΔH<0 正、逆反应的平衡常数K随温度的变化 2SO3(g);ΔH<0 正、逆反应的平衡常数K随温度的变化 |
| C.图③表示10 mL 0.01 mol·L-1 KMnO4酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化 |
| D.图④中a、b曲线分别表示反应CH2=CH2 (g) + H2(g)→CH3CH3(g);ΔH<0使用和未使用催化剂时,反应过程中的能量变化 |
下列有关热化学方程式的叙述,正确的是
| A.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
B.由N2O 4(g)  2NO2(g)△H=" -56.9" kJ·mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ 2NO2(g)△H=" -56.9" kJ·mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ |
| C.由:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,可知:含1mol CH3COOH的溶液与含1mol NaOH的溶液混合,放出热量为57.3 kJ |
| D.已知101kPa时,2C(s)+O2(g)===2CO(g) ΔH=-221kJ/mol,则1 mol碳完全燃烧放出的热量大于110.5kJ |
如下图所示,△H1=-393.5 kJ?mol-1,△H2=-395.4 kJ?mol-1,下列说法或表示式正确的是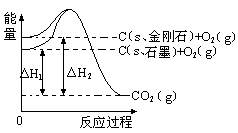
| A.石墨和金刚石的转化是物理变化 |
| B.1mol石墨的总能量比1 mol金刚石的总能量大1.9 kJ |
| C.金刚石的稳定性强于石墨 |
| D.C(s、石墨)=C(s、金刚石) △H=" +1.9" kJ?mol-1 |
相同温度下,甲(恒容)、乙(恒压)、丙(恒容)3个密闭容器中发生可逆反应:
2SO2(g)+O2(g) 2SO3(g)ΔH =" -197" kJ/mol。实验测得起始、平衡时的有关数
2SO3(g)ΔH =" -197" kJ/mol。实验测得起始、平衡时的有关数
据如下表。下列正确的是
| 容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 | ||
| SO2 | O2 | Ar | ||
| 甲 | 2 | 1 | 0 | 放出热量:Q1 |
| 乙 | 2 | 1 | 0 | 放出热量:Q2 |
| 丙 | 2 | 1 | 0.5 | 放出热量:Q3 |
A.Q1 =Q3<Q2
B.达到平衡时,乙容器中SO2的体积分数最大
C.平衡时,甲、乙、丙3个容器中甲的平衡常数最小
D.若在上述条件下,反应生成1molSO3(s),则反应放热为98.5kJ
下列依据热化学方程式得出的结论正确的是( )
| A.已知2H2(g)+O2(g)=2H2O(g);△H=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1 |
| B.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.3 kJ·mol-1 则含40.0g NaOH的稀溶液与稀醋酸完全中和,放出57.3kJ的热量 |
| C.已知C(石墨,s)=C(金刚石,s);△H>0,则石墨比金刚石稳定 |
| D.己知2C(s)+2O2(g)=2CO2(g));△H=a、2C(s)+O2(g)=2CO(g);△H=b,则a>b |