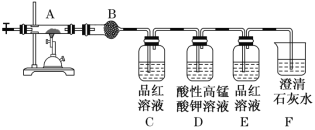
题目内容
【题目】Ⅰ.有一应用前景广阔的纳米材料甲,其由A、B两种短周期非金属元素组成,难溶于水,且硬度大,熔点高。取材料甲与熔融的烧碱反应,生成一种含A元素的含氧酸盐乙和一种含B元素的气体丙,丙能使湿润的红色石蕊试纸变蓝;乙能溶于水,加盐酸产生白色沉淀,盐酸过量沉淀不溶解。
(1)甲的化学式为_________,其晶体属于________晶体
(2)乙的水溶液可以用来做__________________(写出一种用途)
(3)B元素的一种氢化物丁,相对分子质量为32,常温下为液体,其燃烧放热多且燃烧产物对环境无污染,因此可用作火箭燃料、燃料电池燃料等。则丁的电子式为_____________。
Ⅱ.某铜制品在潮湿环境中发生的电化学腐蚀过程可表示为如图,腐蚀后有A物质生成,某小组为分析A物质的组成,进行了如下实验:
实验①:取A样品,加过量稀硝酸完全溶解后,再加入AgNO3溶液,有白色沉淀生成。
实验②:另取A样品4.29g,加入含![]() 的稀硫酸溶液,恰好中和,生成两种盐的混合溶液。向所得混合溶液中加入适量的NaOH溶液,产生蓝色沉淀,经过滤、洗涤、灼烧得3.20g黑色固体。
的稀硫酸溶液,恰好中和,生成两种盐的混合溶液。向所得混合溶液中加入适量的NaOH溶液,产生蓝色沉淀,经过滤、洗涤、灼烧得3.20g黑色固体。
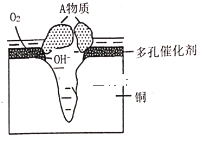
(1)该粉状锈中除了铜元素外还含有(写元素符号)_____元素.
(2)写出该粉状锈溶于稀硫酸反应的离子方程式____。
(3)加热条件下,实验②中所得的黑色固体能与乙醇反应,化学方程式为_____。
【答案】Si3N4 原子 黏合剂、木材等的防腐剂或防火剂 ![]() O、H、Cl
O、H、Cl ![]()
![]()
【解析】
Ⅰ、材料甲与熔融的烧碱反应,生成一种含A元素的含氧酸盐乙和一-种含B元素的气体丙,且能使湿润的红色石蕊试纸变蓝,证明丙气体为NH3,说明甲中含有氮元素;含氧酸盐乙能溶于水,加盐酸产生白色沉淀,盐酸过量沉淀不溶解,说明生成的沉淀为H2SiO3,证明甲中含有硅元素,材料甲,其由A、B两种短周期非金属元素组成,难溶于水,且硬度大,熔点高,证明是一种原子晶体含有氮元素和硅元素,依据元素化合价熟悉得到甲为Si3N4,判断乙为硅酸钠,A为硅元素,B为氮元素;
Ⅰ、(1)分析推断甲为氮化硅,化学式为Si3N4,分析性质判断为原子晶体;故答案为:Si3N4,原子晶体;
(2)乙的水溶液为硅酸钠水溶液,俗称为水玻璃,是一种矿物胶,可以做黏合剂、木材等的防腐剂或防火剂;故答案为:黏合剂、木材等的防腐剂或防火剂;
(3)B元素的一种氢化物丁,相对分子质量为32,常温下为液体,由题意可知丁为N2H4,电子式为:![]() ,故答案为:
,故答案为:![]() ;
;
Ⅱ(1)、根据先加入稀硝酸完全溶解后,再加硝酸银,产生白色沉淀,推出含有Cl元素;再根据另取A样品4.29g,加入含![]() 的稀硫酸溶液,恰好中和,生成两种盐的混合溶液,推出含有氢氧离子,所以含有H、O元素,故答案为O、H、Cl;
的稀硫酸溶液,恰好中和,生成两种盐的混合溶液,推出含有氢氧离子,所以含有H、O元素,故答案为O、H、Cl;
(2)、根据实验②灼烧得到3.2g的黑色固体为氧化铜,物质的量为0.04mol,则铜元素的物质的量为0.04mol,加![]() 恰好中和推知氢氧根的物质的量为0.06mol,再根据化合价推知氯元素的物质的量为0.02mol,所以粉末锈的化学式为Cu2(OH)3Cl,所以粉状锈溶于稀硫酸反应的离子方程式为:
恰好中和推知氢氧根的物质的量为0.06mol,再根据化合价推知氯元素的物质的量为0.02mol,所以粉末锈的化学式为Cu2(OH)3Cl,所以粉状锈溶于稀硫酸反应的离子方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
(3)、加热条件下,黑色固体氧化铜与乙醇反应化学方程式为:![]() ;
;

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案