题目内容
【题目】软锰矿的主要成分为MnO2,还含有SiO2、Al2O3、Fe2O3、FeO等杂质。软锰矿经过综合利用,可制备碳酸锰、氧化铝及绿矾( FeSO47H2O),其制备过程如图:
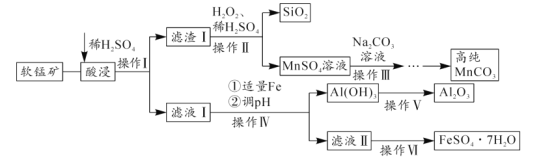
部分物质的Ksp如表:
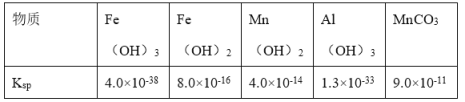
回答下列问题:
(1)操作I中需要的仪器有______(填字母序号)。
a.蒸发皿 b.酒精灯c.漏斗 d.玻璃棒 e.烧杯
(2)操作Ⅱ中反应的离子方程式为______。
(3)操作Ⅲ中也可用NaHCO3与MnSO4溶液反应制备碳酸锰,其反应的离子方程式为______。
(4)操作Ⅳ中加入适量Fe的目的是______;当调节pH=______时(结果保留整数),可确定Al(OH)3完全沉淀。(已知:完全沉淀后,溶液中离子浓度不高于10-5molL-1)
(5)操作Ⅵ中一般要加入稀硫酸,目的是______,然后______、冷却结晶、______、洗涤、干燥。
【答案】cde MnO2+H2O2+2H+=O2↑+Mn2++2H2O Mn2++2HCO3-=MnCO3↓+CO2↑+H2O 将铁离子还原为亚铁离子,以防止在调节溶液的pH时,把铁离子转化为沉淀 5.0 抑制Fe2+水解 蒸发浓缩 过滤
【解析】
软锰矿的主要成分为MnO2,还含有SiO2、Al2O3、Fe2O3、FeO等杂质,用稀硫酸酸浸后,生成硫酸铁、硫酸铝和硫酸亚铁等,二氧化硅、MnO2不反应,过滤分离出滤渣Ⅰ为二氧化硅、MnO2,在滤渣中加过氧化氢和稀硫酸,反应生成水、氧气和MnSO4溶液,二氧化硅不反应,过滤除去;滤液Ⅰ为硫酸铁、硫酸铝和硫酸亚铁,加适量铁将铁离子还原为亚铁离子;调节溶液的pH把铝离子转化为沉淀过滤得Al(OH)3,再灼烧得Al2O3,滤液Ⅱ为硫酸亚铁,要得到绿矾的实验操作Ⅵ是蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
(1)操作I为过滤,需要的仪器有漏斗、玻璃棒、烧杯,故答案为:cde;
(2)由分析可知,MnO2、过氧化氢和稀硫酸反应生成水、氧气和MnSO4溶液,离子方程式为:MnO2+H2O2+2H+=O2↑+Mn2++2H2O,故答案为:MnO2+H2O2+2H+=O2↑+Mn2++2H2O;
(3)操作Ⅲ目的是生成碳酸锰,则加入NaHCO3后,有沉淀碳酸锰生成,有无色气体二氧化碳生成,反应方程式为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O,故答案为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O;
(4)操作Ⅳ中加入适量Fe的目的是将铁离子还原为亚铁离子,以防止在调节溶液的pH时把铁离子转化为沉淀;若使铝离子沉淀完全,铝离子的浓度应小于等于1×10-5mol/L,已知Al(OH)3的溶度积为1.3×10-33,则c(OH-)=![]() mol/L
mol/L![]() 1.0×10-9mol/L,c(H+)=1.0×10-5mol/L,则该溶液的pH=5.0,故答案为:将铁离子还原为亚铁离子,以防止在调节溶液的pH时,把铁离子转化为沉淀;5.0;
1.0×10-9mol/L,c(H+)=1.0×10-5mol/L,则该溶液的pH=5.0,故答案为:将铁离子还原为亚铁离子,以防止在调节溶液的pH时,把铁离子转化为沉淀;5.0;
(5)硫酸亚铁溶液在温度升高时亚铁离子水解程度增大,导致得到的绿矾不纯净,加入稀硫酸能抑制Fe2+水解;溶液中得到绿矾的实验操作是蒸发浓缩、冷却结晶、过滤、洗涤、干燥,故答案为:抑制Fe2+水解;蒸发浓缩;过滤。

 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案