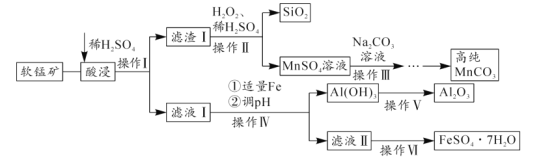
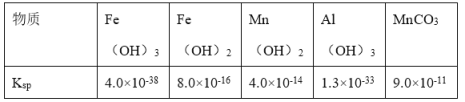
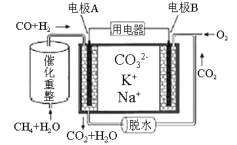
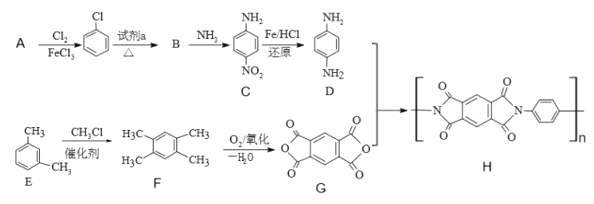
题目内容
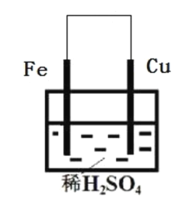
【题目】工业上合成氨,CO易与铁触媒作用导致铁触媒失去催化活性:Fe+5CO═Fe(CO)5.为了防止催化剂铁触媒中毒,要除去CO,发生的反应为Cu(NH3)2OOCCH3+CO+NH3═Cu(NH3)3(CO)OOCCH3.回答下列问题:
(1)下列氮原子的电子排布图表示的状态中,能量最低的是______(填字母序号)。
a.![]() b.
b.![]()
c.![]() d.
d.![]()
(2)写出CO的一种常见等电子体分子的结构式:______;C、N、O的第一电离能由大到小的顺序为______(用元素符号表示)。
(3)与O同族的元素还有S、Se、Te,它们氢化物的沸点大小为H2O>H2Te>H2Se>H2S,其原因是______。
(4)配合物[Cu(NH3)2]OOCCH3中,铜显+1价,则其中碳原子的杂化轨道类型是______,NH3分子的价电子对互斥理论模型是______。
(5)已知铜的一种氧化物Cu2O晶体的晶胞结构如图所示:
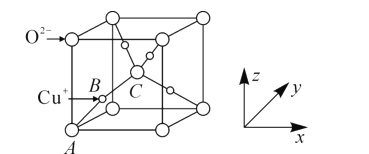
①若坐标参数A为(0,0,0),B为(![]() ),则C的坐标参数为______;
),则C的坐标参数为______;
②若阿伏加德罗常数为NA,该晶胞的边长为a pm,则晶体的密度为______gcm-3。
【答案】a N≡N N>O>C H2Te、H2Se、H2S均是分子晶体,相对分子质量逐渐减小,范德华力减小,所以沸点减小,而水分子中存在氢键,所以沸点最高 sp3、sp2 四面体形 ![]()
![]()
【解析】
(1)基态N的核外电子排布式为1s22s22p3,基态排布为能量最低的排布,电子排布图表示的状态中只有a项符合,故答案为:a;
(2)等电子体为原子总数相同,价电子总数也相同的微粒,与CO互为等电子体的一种分子为N2,其结构式为:N≡N;同周期主族元素,随着原子序数增大,第一电离能呈增大的趋势,但第ⅡA族和第ⅤA族元素反常,所以C、N、O的第一电离能由大到小的顺序为:N>O>C,故答案为:N≡N;N>O>C;
(3)H2Te、H2Se、H2S均是分子晶体,相对分子质量逐渐减小,范德华力减小,所以沸点减小,但由于氢键的作用力比范德华力强,氢键会使沸点异常升高,会导致H2O的沸点异常的高,所以沸点大小为H2O>H2Te>H2Se>H2S,故答案为:H2Te、H2Se、H2S均是分子晶体,相对分子质量逐渐减小,范德华力减小,所以沸点减小,而水分子中存在氢键,所以沸点最高;
(4)甲基中碳原子形成4个σ键,没有孤电子对,杂化轨道数目为4,碳原子杂化方式为sp3,而羰基中C原子形成3个σ键,没有孤电子对,杂化轨道数目为3,碳原子杂化方式为sp2;NH3中N原子形成3个N-H键,含有1对孤对电子,价层电子对数=3+1=4,价电子对互斥理论模型是四面体形,故答案为:sp3、sp2;四面体形;
(5)①根据晶胞结构分析,C位于晶胞体心,则C的原子坐标为:![]() ,故答案为:
,故答案为:![]() ;
;
②1mol晶胞,即有NA个晶胞,质量为m=2×(64×2+16)g=144×2g,所以密度为ρ=![]() ,故答案为:
,故答案为:![]() 。
。

 阅读快车系列答案
阅读快车系列答案