题目内容
下列关于碱金属元素和卤素的说法中,错误的是( )
| A.随核电荷数的增加,碱金属元素和卤素的原子半径都逐渐增大 |
| B.碱金属元素中,锂原子失去最外层电子的能力最弱;卤素中,氟原子得电子的能力最强 |
| C.钠与水的反应不如钾与水的反应剧烈 |
| D.溴单质与水的反应比氯单质与水的反应更剧烈 |
D
解析

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目
我国的纳米技术基础研究能力已跻身于世界前列,例如曾作为我国两年前十大科技成果之一的就是一种合成纳米材料,化学式为RN。已知该化合物中的Rn+核外有28个电子。则R元素位于元素周期表的
( )。
| A.第三周期ⅤA族 | B.第四周期ⅢA族 |
| C.第五周期ⅢA族 | D.第四周期ⅤA族 |
下列不能说明氯元素的非金属性比硫元素强的事实是( )
①HCl比H2S稳定 ②HClO的氧化性比H2SO4强
③HClO4的酸性比H2SO4强
④Cl2能与H2S反应生成S
⑤Cl原子最外层有7个电子,S原子最外层只有6个电子
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS
⑦Cl与S为同周期元素,且Cl的核电荷数比S的大
⑧HCl的水溶液比H2S的水溶液酸性强
| A.①② | B.②⑤⑧ | C.②⑤⑦ | D.①②④ |
最近,我国某物理研究所取得重大科技成果,研制出由18O所形成的单质气体。18O是一种稳定的同位素,称为重氧。下列有关说法不正确的是( )
| A.1.8 g18O形成的气体的物质的量是0.05 mol |
| B.0.1 mol重氧水H218O所含的中子数约为6.02×l023个 |
| C.0.2 mol18O2气体的体积约为4.48 L |
| D.18O2气体的摩尔质量为36 g/mol |
下列有关物质结构和性质的说法中,正确的是( )
| A.元素非金属性Cl>S的实验依据是酸性HCl>H2S。 |
| B.碳元素的电负性小于氧元素,每个CO2分子中有4个σ键 |
| C.同周期主族元素的原子形成的简单离子的电子层结构一定相同 |
| D.Na、Mg、Al三种元素,其第一电离能由大到小的顺序为Mg>Al>Na |
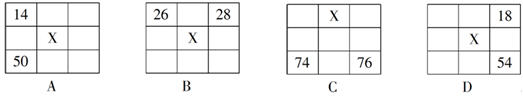
X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示。已知Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是( )
| A.原子半径:W>Z>Y>X |
| B.最高价氧化物对应水化物的酸性:Z>W>X |
| C.氢化物的稳定性:X>Y>Z |
| D.四种元素的单质中,Z单质的熔、沸点最高 |
下列有关物质的性质或结构的说法正确的是( )
| A.L层上的电子数为奇数的原子一定是主族元素的原子 |
| B.周期表中的碱金属元素从上到下,其单质的还原性逐渐增强,熔沸点逐渐升高 |
| C.化学键的形成一定伴随着电子的转移和能量变化 |
| D.元素周期表中,位于金属和非金属分界线附近的元素属于过渡元素 |
YBa2Cu8Ox(Y为元素钇)是磁悬浮列车中的重要超导材料,下列关于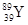 的说法不正确的是( )
的说法不正确的是( )
| A.属于金属元素 | B.质子数与中子数之差为50 |
| C.原子的核外电子数是39 | D.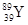 和 和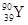 是两种不同的核素 是两种不同的核素 |