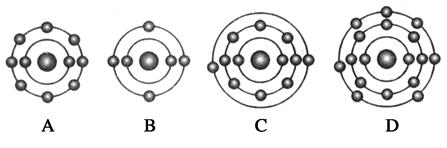
题目内容
下列不能说明氯元素的非金属性比硫元素强的事实是( )
①HCl比H2S稳定 ②HClO的氧化性比H2SO4强
③HClO4的酸性比H2SO4强
④Cl2能与H2S反应生成S
⑤Cl原子最外层有7个电子,S原子最外层只有6个电子
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS
⑦Cl与S为同周期元素,且Cl的核电荷数比S的大
⑧HCl的水溶液比H2S的水溶液酸性强
| A.①② | B.②⑤⑧ | C.②⑤⑦ | D.①②④ |
B
解析

练习册系列答案
相关题目
元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1~36号元素),对比中
学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是
| A.②、⑧、⑨对应简单离子半径依次减小 |
| B.⑥的氯化物的熔点比⑦的氯化物熔点低 |
| C.元素⑩处于常见周期表第四周期第VIIIB族 |
| D.①分别与③、④、⑤均可形成既含极性键又含非极性键的化合物 |
镭是元素周期表中第7周期第ⅡA族元素,关于其叙述不正确的是( )。
| A.镭的金属性比钙弱 |
| B.单质能与水反应生成H2 |
| C.镭在化合物中呈+2价 |
| D.碳酸镭难溶于水 |
运用元素周期律分析下面的判断,其中错误的是( )
| A.铍(Be)的氧化物的水化物可能具有两性 |
| B.砹(At)为白色固体,HAt不稳定,AgAt感光性很强 |
| C.硫酸锶(SrSO4)是难溶于水的白色固体 |
| D.硒化氢(H2Se)无色、有毒,比H2S更不稳定 |
短周期的两种元素A和B,它们的离子A-和B2+具有相同的电子层结构,下列说法中正确的是( )
| A.原子序数A>B | B.电子总数A->B2+ |
| C.离子半径A->B2+ | D.原子半径A>B |
有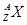 和
和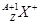 两种粒子,下列叙述正确的是( )
两种粒子,下列叙述正确的是( )
| A.一定都是由质子、中子、电子构成的 |
| B.化学性质几乎完全相同 |
| C.质子数一定相等,质量数和中子数一定不相等 |
| D.核电荷数和核外电子数一定相等 |
下列关于碱金属元素和卤素的说法中,错误的是( )
| A.随核电荷数的增加,碱金属元素和卤素的原子半径都逐渐增大 |
| B.碱金属元素中,锂原子失去最外层电子的能力最弱;卤素中,氟原子得电子的能力最强 |
| C.钠与水的反应不如钾与水的反应剧烈 |
| D.溴单质与水的反应比氯单质与水的反应更剧烈 |
 。下列原子中,与氟元素原子的化学性质相似的是( )
。下列原子中,与氟元素原子的化学性质相似的是( )