题目内容
最近,我国某物理研究所取得重大科技成果,研制出由18O所形成的单质气体。18O是一种稳定的同位素,称为重氧。下列有关说法不正确的是( )
| A.1.8 g18O形成的气体的物质的量是0.05 mol |
| B.0.1 mol重氧水H218O所含的中子数约为6.02×l023个 |
| C.0.2 mol18O2气体的体积约为4.48 L |
| D.18O2气体的摩尔质量为36 g/mol |
C
解析

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
钠和锂有相似的化学性质,下列说法中,能较好地解释这个事实的是( )。
| A.都是金属元素 | B.原子半径相差不大 | C.最外层电子数相同 | D.化合价相同 |
运用元素周期律分析下面的判断,其中错误的是( )
| A.铍(Be)的氧化物的水化物可能具有两性 |
| B.砹(At)为白色固体,HAt不稳定,AgAt感光性很强 |
| C.硫酸锶(SrSO4)是难溶于水的白色固体 |
| D.硒化氢(H2Se)无色、有毒,比H2S更不稳定 |
短周期的两种元素A和B,它们的离子A-和B2+具有相同的电子层结构,下列说法中正确的是( )
| A.原子序数A>B | B.电子总数A->B2+ |
| C.离子半径A->B2+ | D.原子半径A>B |
有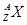 和
和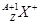 两种粒子,下列叙述正确的是( )
两种粒子,下列叙述正确的是( )
| A.一定都是由质子、中子、电子构成的 |
| B.化学性质几乎完全相同 |
| C.质子数一定相等,质量数和中子数一定不相等 |
| D.核电荷数和核外电子数一定相等 |
短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4:3,Z原子比X原子的核外电子数多4。下列说法正确的是( )
| A.W、Y、Z的电负性大小顺序一定是Z>Y>W |
| B.W、X、Y、Z的原子半径大小顺序可能是W>X>Y>Z |
| C.Y、Z形成的分子的空间构型可能是正四面体 |
| D.WY2分子中σ键与π键的数目之比是2:1 |
下列关于碱金属元素和卤素的说法中,错误的是( )
| A.随核电荷数的增加,碱金属元素和卤素的原子半径都逐渐增大 |
| B.碱金属元素中,锂原子失去最外层电子的能力最弱;卤素中,氟原子得电子的能力最强 |
| C.钠与水的反应不如钾与水的反应剧烈 |
| D.溴单质与水的反应比氯单质与水的反应更剧烈 |
X、Y、Z三种短周期元素,原子半径的大小关系为r(Y)>r(X)>r(Z),原子序数之和为16。X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子。下列说法不正确的是( )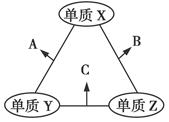
| A.X元素位于第ⅥA族 | B.A不能溶解于B中 |
| C.A和C不可能发生氧化还原反应 | D.B的沸点高于C的沸点 |
X、Y、Z、W为四种短周期主族元素,它们在周期表中的相对位置如图所示。Z元素原子核外K层与M层电子数相等。下列说法中正确的是( )
| | | X | Y |
| Z | W | | |
A.Y元素最高价氧化物对应的水化物化学式为H3YO4
B.原子半径由小到大的顺序为:X<Z<Y<W
C.与同浓度的盐酸反应,Z比W更剧烈
D.X的氧化物不能与Z单质反应